
题目列表(包括答案和解析)
铁、铝及其化合物在生产和生活中有着广泛的应用。
(1)某研究性学习小组设计了如下图所示装置探究钢铁的腐蚀与防护。

在相同条件下,三组装置中铁电极腐蚀最快的是 (填装置序号),该装置中正极电极反应式为 ;为防止金属Fe被腐蚀,可以采用上述 (填装置序号)装置原理进行防护;装置③中总反应的离子方程式为 。
(2)新型固体LiFePO4隔膜电池广泛应用于电动汽车。
电池反应为FePO4+Li ![]() LiFePO4,电解质为含Li+的导电固体,且充、放电时电池内两极间的隔膜只允许Li+自由通过而导电。该电池放电时Li+向 极移动(填“正”或“负”),负极反应为Li-e-=Li+,则正极反应式为 。
LiFePO4,电解质为含Li+的导电固体,且充、放电时电池内两极间的隔膜只允许Li+自由通过而导电。该电池放电时Li+向 极移动(填“正”或“负”),负极反应为Li-e-=Li+,则正极反应式为 。
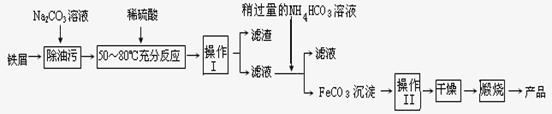 (3)铁在元素周期表中的位置是 。
(3)铁在元素周期表中的位置是 。
氧化铁是重要工业颜料,用废铁屑制备它的流程如下:回答下列问题:
①操作Ⅰ、Ⅱ的名称分别是____ 、____。
②写出在空气中煅烧FeCO3的化学方程式 ;
(4)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定(5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)。 a.称取2.850g绿矾(FeSO4·7H2O)产品,溶解,在250mL容量瓶中定容; b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,
配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需_______________。
②计算上述样品中FeSO4·7H2O的质量分数为
铁、铝及其化合物在生产和生活中有着广泛的应用。
(1)某研究性学习小组设计了如下图所示装置探究钢铁的腐蚀与防护。
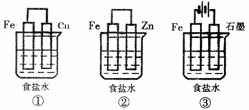
在相同条件下,三组装置中铁电极腐蚀最快的是 (填装置序号),该装置中正极电极反应式为 ;为防止金属Fe被腐蚀,可以采用上述 (填装置序号)装置原理进行防护;装置③中总反应的离子方程式为
。
(2)新型固体LiFePO4隔膜电池广泛应用于电动汽车。电池反应为
FePO4+Li ![]() LiFePO4,电解质为含Li+的导电固体,且充、放电时电池内两极间的隔膜只允许Li+自由通过而导电。该电池放电时Li+向 极移动(填“正”或“负”),负极反应为Li-e-=Li+,则正极反应式为 。
LiFePO4,电解质为含Li+的导电固体,且充、放电时电池内两极间的隔膜只允许Li+自由通过而导电。该电池放电时Li+向 极移动(填“正”或“负”),负极反应为Li-e-=Li+,则正极反应式为 。
(3)铁在元素周期表中的位置是 。
氧化铁是重要工业颜料,用废铁屑制备它的流程如下:回答下列问题:
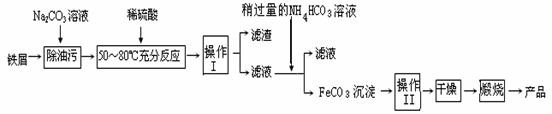
①操作Ⅰ、Ⅱ的名称分别是__ __ 、__ __。
②写出在空气中煅烧FeCO3的化学方程式 ;
(4)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定(5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)。
a.称取2.850g绿矾(FeSO4·7H2O)产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,
配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需_______________。
②计算上述样品中FeSO4·7H2O的质量分数为
铁、铝及其化合物在生产和生活中有着广泛的应用。
(1)某研究性学习小组设计了如下图所示装置探究钢铁的腐蚀与防护。

在相同条件下,三组装置中铁电极腐蚀最快的是 (填装置序号),该装置中正极电极反应式为 ;为防止金属Fe被腐蚀,可以采用上述
(填装置序号)装置原理进行防护;装置③中总反应的离予方程式为
。
(2)新型固体LiFePO4隔膜电池广泛应用于电动汽车。
|
|
负极反应为Li-e-=Li+,则正极反应式为 。
(3)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:回答下列问题:
①操作I、Ⅱ的名称分别是 、 。
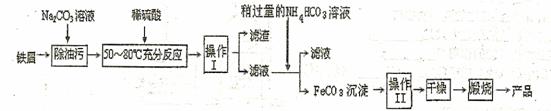
②写出在空气中锻烧FeCO3的化学方程式 ;
(4)有些同学认为![]() 溶液滴定也能进行铁元素含量的测定(
溶液滴定也能进行铁元素含量的测定(![]() )。
)。
a.称取2.850g绿矾 (FeSO4·7H2O)产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/KMnO4溶液滴定至终点,消耗![]() 溶液体积的平均值为 20.00mL。计算上述样品中FeSO4·7H2O的质量分数为
溶液体积的平均值为 20.00mL。计算上述样品中FeSO4·7H2O的质量分数为

| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com