
题目列表(包括答案和解析)

铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原-氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlC13(g)+3C(s) =3AlCl(g)+3CO(g) △H=a kJ·mol-1
3AlCl(g)=2Al(l)+AlC13(g) △H=b kJ·mol-1
①反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H= kJ·mol-1(用含a、b 的代数式表示)。
②Al4C3是反应过程中的中间产物。Al4C3 与盐酸反应(产物之一是含氢量最高的烃) 的化学方程式为 。
 (2)镁铝合金(Mg17Al12 )是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al 单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为Mg17Al122+17H2=17MgH2+12Al。得到的混合物Y(17MgH2 +12Al)在一定条件下可释放出氢气。
(2)镁铝合金(Mg17Al12 )是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al 单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为Mg17Al122+17H2=17MgH2+12Al。得到的混合物Y(17MgH2 +12Al)在一定条件下可释放出氢气。
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是 。
②在6. 0 mol·L-1 HCl 溶液中,混合物Y 能完全释放出H2。1 mol Mg17 Al12 完全吸氢后得到的混合物Y 与上述盐酸完全反应,释放出H2 的物质的量为 。
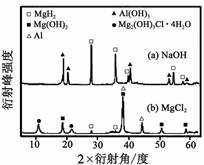
 ③在0. 5 mol·L-1 NaOH 和1. 0 mol·L-1 MgCl2溶液中, 图8
③在0. 5 mol·L-1 NaOH 和1. 0 mol·L-1 MgCl2溶液中, 图8
混合物Y 均只能部分放出氢气,反应后残留固体物质的X-射线衍射谱图如图8 所示(X-射线衍射可用于判断某晶态物
质是否存在,不同晶态物质出现衍射峰的衍射角不同)。在上述NaOH 溶液中,混合物Y 中产生氢气的主要物质是
(填化学式)。
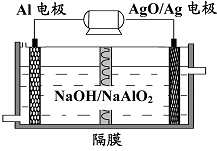
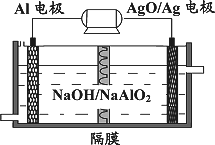
(3)铝电池性能优越,Al-AgO 电池可用作水下动力电源,
其原理如图9所示。该电池反应的化学方程式为 。
图9
铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原-氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g) △H=a kJ·mol-1
3AlCl(g)=3Al(l)+AlCl3(g) △H=b kJ·mol-1
①反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H= kJ·mol-1(用含a、b的代数式表示)。
②Al4C3是反应过程的中间产物。Al4C3与盐酸反应(产物之一是含氢量最高的烃)的化学方程式 。
(2)镁铝合金(Mg17Al12)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为
Mg17Al12+17H2=17MgH2+12Al。得到的混合物Y(17MgH2+12Al)在一定条件下释放出氢气。
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是 。
 ②在6.0mol·L-1HCl溶液中,混合物Y能完全释放出H2。1 mol Mg17Al12完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出H2的物质的量为 。
②在6.0mol·L-1HCl溶液中,混合物Y能完全释放出H2。1 mol Mg17Al12完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出H2的物质的量为 。
③在0.5 mol·L-1 NaOH和1.0 mol·L-1 MgCl2溶液中,
混合物Y均只能部分放出氢气,反应后残留固体物质X-射线衍射谱图如右图所示(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。在上述NaOH溶液中,混合物Y中产生氢气的主要物质是 (填化学式)。
(3)铝电池性能优越,Al-AgO电池可用作水下
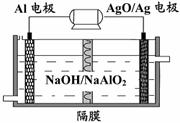 动力电源,其原理如右下图所示。该电池反应
动力电源,其原理如右下图所示。该电池反应
的化学方程式为:
。

铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛.
(1)真空碳热还原-氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlC13(g)+3C(s)![]() 3AlCl(g)+3CO(g) ΔH=a kJ·mol-1
3AlCl(g)+3CO(g) ΔH=a kJ·mol-1
3AlCl(g)=2Al(l)+AlC13(g) ΔH=b kJ·mol-1
①反应Al2O3(s)+3C(s)![]() 2Al(l)+3CO(g)的ΔH=________kJ·mol-1(用含a、b的代数式表示).
2Al(l)+3CO(g)的ΔH=________kJ·mol-1(用含a、b的代数式表示).
②Al4C3是反应过程中的中间产物.Al4C3与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为________.
(2)镁铝合金(Mg17Al12)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得.该合金在一定条件下完全吸氢的反应方程式为Mg17Al122+17H2=17MgH2+12Al.得到的混合物Y(17MgH2+12Al)在一定条件下可释放出氢气.
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是________.
②在6.0 mol·L-1 HCl溶液中,混合物Y能完全释放出H2.1 mol Mg17 Al12完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出H2的物质的量为________.
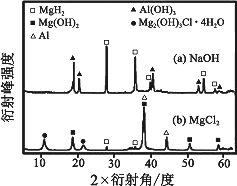
③在0.5 mol·L-1 NaOH和1.0 mol·L-1 MgCl2溶液中,混合物Y均只能部分放出氢气,反应后残留固体物质的X-射线衍射谱图如图所示(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同).在上述NaOH溶液中,混合物Y中产生氢气的主要物质是________(填化学式).
(3)铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.该电池反应的化学方程式为________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com