
题目列表(包括答案和解析)
控制、治理氮氧化物对大气的污染是改善大气质量的重要方面。
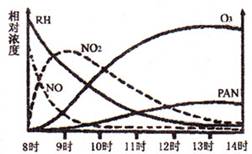 (1)光化学烟雾白天生成,傍晚消失,其主要成分为RH(烃)、NO、NO2、O3、PAN(CH3COOONO2),某地早上至中午这些物质的相对浓度变化如右图所示,则下列叙述合理的是 。(填字母)
(1)光化学烟雾白天生成,傍晚消失,其主要成分为RH(烃)、NO、NO2、O3、PAN(CH3COOONO2),某地早上至中午这些物质的相对浓度变化如右图所示,则下列叙述合理的是 。(填字母)
a.早上8时交通繁忙期,光化学烟雾的主要成分为RH、NO
b.14时,光化学烟雾的主要成分为O3、PAN
c.PAN、O3由RH和NO直接反应生成
d.PAN直接由O3转化生成
(2)火力发电厂的燃煤排烟中含大麓的氮氧化物(NOx),可利用甲烷和NOx一定条件下反应消除其污染,则CH4与NO2反应的化学方程式为 。
(3)在一密闭容器中发生反应2NO2![]() 2NO+O2,反应过程中NO2的浓度随时间变化的情况如右下图所示。请回答:
2NO+O2,反应过程中NO2的浓度随时间变化的情况如右下图所示。请回答:
① 依曲线A,反应在前3 min内氧气的平均反应速率为 。
② 若曲线A、B分别表示的是该反应在某不同条件下的反应情况,则此条件是 (填“浓度”、“压强”、“温度”或“催化剂”)。
③ 曲线A、B分剐对应的反应平衡常数的大小关系是![]()
![]() 。(填“>”、“<”或“=”)
。(填“>”、“<”或“=”)
(4)一定温度下,在匦容密闭容器中N2O5可发生下列反应:
2N2O5(g)![]() 4NO2(g)+O2(g) Ⅰ
4NO2(g)+O2(g) Ⅰ
2NO2(g)![]() 2NO(g)+O2(g) Ⅱ
2NO(g)+O2(g) Ⅱ
则反应Ⅰ的平衡常数表达式为 。若达平衡时,![]() (NO2)=0.4 mol?L
(NO2)=0.4 mol?L![]() ,
,![]() (O2)=1.3 mol?L
(O2)=1.3 mol?L![]() ,则反应Ⅱ中NO2的转化率为 ,N2O5(g)的起始浓度应不低于 mo1?L
,则反应Ⅱ中NO2的转化率为 ,N2O5(g)的起始浓度应不低于 mo1?L![]() 。
。
| 1 |
| 2 |
| c(N2)c2(CO2) |
| c2(NO)c2(CO) |
| c(N2)c2(CO2) |
| c2(NO)c2(CO) |

| C4(NO2)C(O2) |
| C2(N2O5) |
| C4(NO2)C(O2) |
| C2(N2O5) |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com