
题目列表(包括答案和解析)
硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气。一定温度下,在密闭容器中充入ImolN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的![]() ,则N2的转化率
,则N2的转化率![]() ;若容器压强恒定,达到平衡状态时,N=的转化率为
;若容器压强恒定,达到平衡状态时,N=的转化率为![]() ,则
,则![]()
![]() (‘填“>”、“<”或“=”)。
(‘填“>”、“<”或“=”)。
(2)用氨催化氧化法可生产硝酸,其生产过程可表示为:
4NH3+5O2 4NO+6H2O 4NO+3O2+2H2O=4HNO3
现以3.4吨液氨为原料来生产质量分数为50%的硝酸,理论上需要加水的质量为
吨。(假设生产过程中反应物和生成物均无损耗)
(3)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2+Na2CO3=NaNO2+NaNO3+CO2,NO+NO2+Na2CO3=2NaNO2+CO2。若在标准状况下有NO、NO2的混合气体(不考虑N2O4)恰好与50mL 1. 0 mol·L-1的Na2CO3溶液反应完全,且生成NaNO2和NaNO3的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程)
某同学采用如图装置进行实验,证明了铜与稀硝酸反应生成了NO。实验时,先向注射器内加入一定量的稀硝酸,排净注射器内的空气,迅速将带有铜丝的橡皮帽盖上,一段时间后,注射器内有无色气体产生。
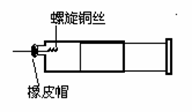
(1)请写出铜与稀硝酸反应的化学方程式:
。
(2)若证明无色气体是NO的实验操作和现象是
。
一氧化氮是大气污染物之一。目前,有一种治理方法是在400 ℃左右、有催化剂存在的情况下,用氨把一氧化氮还原为氮气和水。该反应的化学方程式为
4NH3+6NO5N2+6H2O ,
每有10mol N2生成,被还原的氧化剂为___________________mol。
(3)若将上述稀硝酸换成浓硝酸,其生成的气体为 ,将此气体通入水中,发生反应的化学方程式为:
。
关于某溶液中所含离子的鉴别,下列判断正确的是
A.加入BaCl2溶液,生成白色沉淀,加稀硝酸沉淀不消失,则原溶液中一定含有SO42-
B.加入NaOH溶液,生成的白色沉淀在空气中迅速变为灰绿色,最终![]() 变为红褐色,则原溶液中一定含有Fe2+
变为红褐色,则原溶液中一定含有Fe2+
C.用洁净的铂丝蘸取溶液在火焰上灼烧,产生黄色的火焰,则原溶液中一定不含有K+
D.加盐酸生成的气体能使澄清石灰水变浑浊,则原溶液中一定含有CO32-
| A、K+ 1s22s22p63s23p6 | B、As 1s22s22p63s23p63d104s24p3 | C、N3- 1s22s22p6 | D、Cr 1s22s22p63s23p63d44s2 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com