
题目列表(包括答案和解析)
下列关于物质“反应程度”的说法正确的是
A.一定条件下,2mol SO2与足量O2反应可得到2mol SO3
B.含4mol HCl 的浓盐酸与足量的MnO2加热反应可制备1mol Cl2
C.10ml 18.0 mol/L H2SO4与足量铜加热反应可制备0.09 mol SO2
D.一定条件下,1mol N2与3 mol H2反应可制备1.0 mol NH3
下列关于物质“反应程度”的说法正确的是
A.一定条件下,2mol SO2与足量O2反应可得到2mol SO3
B.含4mol HCl 的浓盐酸与足量的MnO2加热反应可制备1mol Cl2
C.10ml 18.0 mol/L H2SO4与足量铜加热反应可制备0.09 mol SO2
D.一定条件下,1mol N2与3 mol H2反应可制备1.0 mol NH3
下列关于物质“反应程度”的说法正确的是( )
A.一定条件下,2molsO2与足量O2反应可得到2molsO3
B.含4mol HCl的浓盐酸与足量的MnO2加热反应可制备1mol Cl2
C.10mL 18.0mol/L H2SO4与足量铜加热反应可制备0.09molsO2
D.一定条件下,1mol N2与3mol H2反应可制备1.0mol NH3
| A.一定条件下,2molsO2与足量O2反应可得到2molsO3 |
| B.含4mol HCl的浓盐酸与足量的MnO2加热反应可制备1mol Cl2 |
| C.10mL 18.0mol/L H2SO4与足量铜加热反应可制备0.09molsO2 |
| D.一定条件下,1mol N2与3mol H2反应可制备1.0mol NH3 |
下列有关物质性质应用的说法正确的是
A.SO2具有漂白性,可用作熏蒸粉丝使其增白
B.常温下二氧化硅不与强酸反应,可用石英容器盛放氢氟酸
C.铜的金属活泼性比铁的弱,可在铁船闸上装若干铜块以减缓其腐蚀
D.氧化铝熔点很高,可用作制造高温耐火材料,如制耐火砖、坩埚等常用作催熟剂、除草剂等,实验室用卤块(主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质)制备少量Mg(ClO3)2·6H2O的流程如下:

已知:几种化合物的溶解度(S)随温度(T)变化曲线如下图所示。
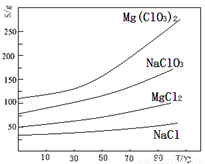
(1)过滤时主要玻璃仪器有 。加入BaCl2的目的是除去杂质离子,检验已沉淀完全的方法是: 。
(3)“调节pH=4”可选用的试剂是 (填编号)
①MgO ②CuO ③稀NaOH溶液
④Mg ⑤稀硫酸 ⑥MgCO3
(4)反应II为:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:① ;②趁热过滤;③ ;④过滤、洗涤、干燥。
(5)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量m g产品配成100 mL溶液。
步骤2:取10 mL溶液于锥形瓶中,加入10 mL稀硫酸和20 mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol·L-1 K2Cr2O7标准溶液滴定未被氧化的Fe2+。记录消耗K2Cr2O7溶液的体积。
①步骤2中发生反应的离子方程式为: 。
②若配制K2Cr2O7标准溶液时未洗涤烧杯,则产品中Mg(ClO3)2·6H2O的含量会 。(填“偏高”、“偏低” 或“不变”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com