
题目列表(包括答案和解析)
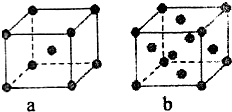 已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E.又知A原子的p轨道为半充满,其形成的氢化物的沸点是同主族非金属元素的氢化物中最高的.D原子得到一个电子后其3p轨道将全充满.B+离子比D原子形成的离子少一个电子层.C与B可形成BC型的离子化合物.E的原子序数为29.
已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E.又知A原子的p轨道为半充满,其形成的氢化物的沸点是同主族非金属元素的氢化物中最高的.D原子得到一个电子后其3p轨道将全充满.B+离子比D原子形成的离子少一个电子层.C与B可形成BC型的离子化合物.E的原子序数为29.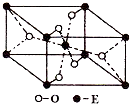 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D元素是地壳中含量最多的元素.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D元素是地壳中含量最多的元素.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.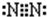
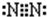
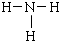
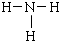
| ||
| ||
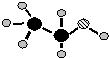 已知A、B、C、D、E是短周期中的五种元素,它们的原子序数依次增大.A和B可形成常见化合物BA4,一个BA4分子中电子总数为10;C原子的最外层电子数是核外电子总数的
已知A、B、C、D、E是短周期中的五种元素,它们的原子序数依次增大.A和B可形成常见化合物BA4,一个BA4分子中电子总数为10;C原子的最外层电子数是核外电子总数的| 3 |
| 4 |
| 催化剂 |
| △ |
| 催化剂 |
| △ |
| 一定条件 |
| 一定条件 |
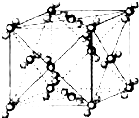 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.其中B、D、F原子最外电子层的P能级(轨道)上的电子处于半满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如图所示.E的电负性在该周期中最大.镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaF为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.其中B、D、F原子最外电子层的P能级(轨道)上的电子处于半满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如图所示.E的电负性在该周期中最大.镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaF为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com