
题目列表(包括答案和解析)
 NH3?H2O
NH3?H2O NH4++OH-
NH4++OH- NH3?H2O
NH3?H2O NH4++OH-
NH4++OH-
| ||
| ||
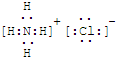
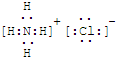

| 浓H2SO4 |
| △ |
| 浓H2SO4 |
| △ |


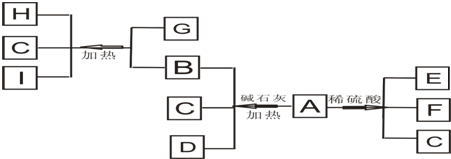
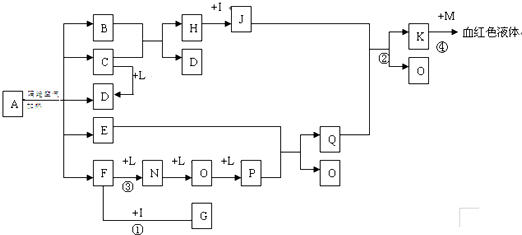
(14分)已知A为一无机盐,C、D、F、N、O为无色气体,E常温常压下为无色无味的液体,N、H、L为高中常见的单质,I为常见无氧强酸,M的焰色反应为紫色,反应①常用于气体F的检验。
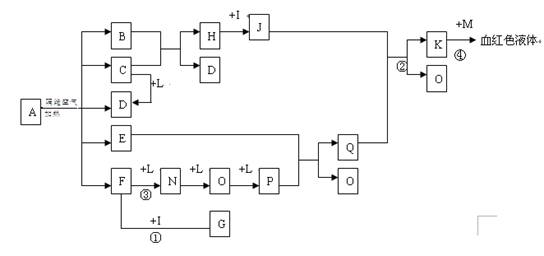
(1)写出G的电子式_______________,M的化学式_____________;
(2)写出反应②的离子反应方程式______________________________;
(3)写出反应③的化学反应方程式_____________;反应1-4中属于非氧化还原反应的是 ;
(4)用石墨电极电解溶液K时,电解初始阶段电极反应方程式为:
阴极___________________
阳极___________________
(5)已知A在隔绝空气条件下分解产生的各产物的物质的量之比为B:C:D:E:F=1:2:2:2:2,写出A分解的反应方程式__________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com