
题目列表(包括答案和解析)
| 实验编号 | 温度(℃) | 大理石规格 | HNO3浓度(mol/L) | 实验目的 |
| ① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究浓度对反应速率的影响; (Ⅱ)实验①和③探究温度对反应速率的影响; (Ⅲ)实验①和④探究 固体的表面积 固体的表面积 对反应速率的影响; |
| ② | 25 25 |
粗颗粒 粗颗粒 |
1.00 1.00 | |
| ③ | 35 35 |
粗颗粒 粗颗粒 |
2.00 2.00 | |
| ④ | 25 25 |
细颗粒 细颗粒 |
2.00 2.00 |
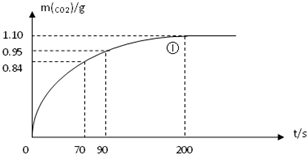
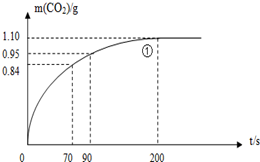 某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.所用HNO3浓度为1.00mol/L、2.00mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00mL,大理石用量为10.00g.
某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.所用HNO3浓度为1.00mol/L、2.00mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00mL,大理石用量为10.00g.| 实验 编号 |
温度 (℃) |
大理石 规格 |
HNO3浓度(mol/L) | 实验目的 |
| ① | 25 | 粗颗粒 | 2.00 | (I)实验①和②探究浓度对反应速率的影响; (II)实验①和③探究温度对反应速率的影响; (III)实验①和④探究 固体物质的表面积 固体物质的表面积 对反应速率的影响 |
| ② | 25 | 粗颗粒 | 1.00 1.00 | |
| ③ | 35 35 |
粗颗粒 | 2.00 | |
| ④ | 25 | 细颗粒 | 2.00 |
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol?L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和 (Ⅲ)实验①和 |
| ② | ||||
| ③ | ||||
| ④ |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
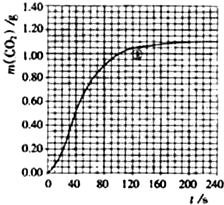
某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL、大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol·L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和 探究温度对该反应速率的影响; (Ⅲ)实验①和 探究大理石规格(粗、细)对该反应速率的影响;) |
| ② | ||||
| ③ | ||||
| ④ |
(2)实验①中CO2质量随时间变化的关系见下图:
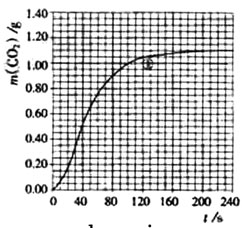
依据反应方程式![]() CaCO3+HNO3=
CaCO3+HNO3=![]() Ca(NO3)2+
Ca(NO3)2+![]() CO2↑+
CO2↑+![]() H2O,计算实验①在70-90 s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)。
H2O,计算实验①在70-90 s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)。
(3)请在答题卡的框图中,画出实验②、③和④中CO2质量随时间变化关系的预期结果示意图。
(8分)某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00mol/L、2.00mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00mL,大理石用量为10.00g。
(1)请完成以下实验设计表,并在实验目的一栏中填空:
| 实验 编号 | 温度 (℃) | 大理石 规格 | HNO3浓度(mol/L) | 实验目的 |
| ① | 25 | 粗颗粒 | 2.00 | (I)实验①和②探究浓度对反应速率的影响; (II)实验①和③探究温度对反应速率的影响; (III)实验①和④探究 对反应速率的影响 |
| ② | 25 | 粗颗粒 |
| |
| ③ |
| 粗颗粒 | 2.00 | |
| ④ | 25 | 细颗粒 | 2.00 |
(2)实验①中CO2质量随时间变化的关系见下图。计算实验①中70s-90s范围内用HNO3/*-表示的平均反应速率 (忽略溶液体积变化,不需要写出计算过程)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com