
(2012?虹口区二模)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上利用H
2和CO
2合成二甲醚的反应如下:6H
2(g)+2CO
2(g)?CH
3OCH
3(g)+3H
2O(g)
已知该反应平衡常数(K)与温度(T)的关系如图所示.
(1)一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应达到化学平衡状态的是
ad
ad
(选填编号).
a.c(H
2)与c(H
2O)的比值保持不变 b.单位时间内有2mol H
2消耗时有1mol H
2O生成
c.容器中气体密度不再改变 d.容器中气体压强不再改变
(2)温度升高,该化学平衡移动后到达新的平衡,CH
3OCH
3的产率将
变小
变小
(填“变大”、“变小”或“不变”,下同),混合气体的平均式量将
变小
变小
.
(3)一定温度和压强下,往体积为20L的容器中通入一定物质的量的H
2与CO
2,达到平衡时,容器中含有0.1mol二甲醚.计算H
2的平均反应速率:
mol/(L.s),t-达到平衡所需的时间(单位:s,可自定)
mol/(L.s),t-达到平衡所需的时间(单位:s,可自定)
(用字母表示所缺少的物理量并指明其含义).
(4)工业上为提高CO
2的转化率,采取方法可以是
bc
bc
(选填编号).
a.使用高效催化剂 b.增大体系压强
c.及时除去生成的H
2O d.增加原料气中CO
2的比例.

 (2012?虹口区二模)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)?CH3OCH3(g)+3H2O(g)
(2012?虹口区二模)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)?CH3OCH3(g)+3H2O(g)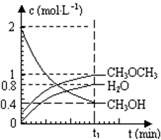 已知二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=23.5kJ?mol-1.在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示.请回答下列问题:
已知二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=23.5kJ?mol-1.在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示.请回答下列问题: