
题目列表(包括答案和解析)
| 温度℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | |
| 溶解度/g | Na2CO3 | 7.00 | 12.5 | 21.5 | 39.7 | 49.0 | 46.0 | 43.9 |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.3 | 38.4 | |
| 温度℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | |
| 溶解度/g | Na2CO3 | 7.00 | 12.5 | 21.5 | 39.7 | 49.0 | 46.0 | 43.9 |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.3 | 38.4 | |
| 物质 | NaCl | NH4CO3 | NH4Cl | NaHCO3 |
| 溶解度 | 36.0 | 21.6 | 37.2 | 9.6 |

| 物质 | NaCl | NH4CO3 | NH4Cl | NaHCO3 |
| 溶解度 | 36.0 | 21.6 | 37.2 | 9.6 |
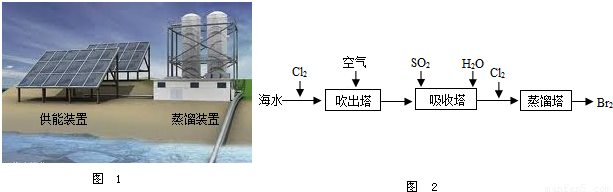
(7分)水在日常生活、工农业生产、科学研究领域有着重要及广泛的用途。
(1)从化学视角看水。从组成角度看,电解水实验证明了水由____组成;从微粒角度看,水由____(填“分子”、“原子”或“离子”)构成。
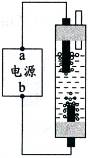
(2)水能参加许多化学反应。右图是一种家用环保型消毒液发生器:原理是电解饱和氯化钠溶液,制得的消毒液有较强的杀菌能力,该反应是利用氯化钠和水在通电条件下生成氢氧化钠、氢气和氯气,该反应的化学方程式为____;从能量变化角度看,该反应中____转化为化学能。
(3)水是一种重要的溶剂。下表表示的是不同温度下4种盐在水中的溶解度。
|
|
10℃ |
20℃ |
30℃ |
|
NaCI |
35.8 |
36.0 |
36.3 |
|
NH4HCO3 |
15.8 |
21.0 |
27.O |
|
NaHCO3 |
8.1 |
9.6 |
11.1 |
|
NH4Cl |
33.3 |
37.2 |
41.4 |
回答问题:
①上述4种盐中,30℃时溶解度最大的是____。
②10℃时将16.8gNH4HCO3固体放入100g水中充分溶解,所得溶液为____ (填“饱和”或“不饱和”)溶液。
③在20℃时,向含NH4HCO3 21 g的饱和溶液中加入足量食盐。随着食盐的加入,能析出的晶体是____。
A.NH4HCO3 B. NH4Cl C.NaHCO3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com