
题目列表(包括答案和解析)
(14分)一定条件下铁可以和![]() 发生反应:
发生反应:![]() ,已知该反应的平衡常数(
,已知该反应的平衡常数(![]() )与温度(
)与温度(![]() )的关系如图甲所示:
)的关系如图甲所示:
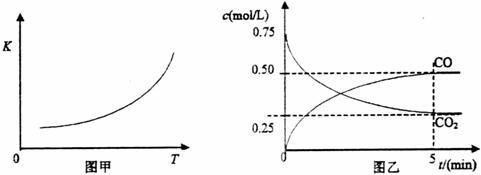
(1)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的![]() 气体,反应过程中
气体,反应过程中
![]() 气体和
气体和![]() 气体的浓度与时间的关系如图乙所示。5min内,CO的平均反应速率
气体的浓度与时间的关系如图乙所示。5min内,CO的平均反应速率![]() =_________________mol/(L?min)。
=_________________mol/(L?min)。
(2)下列措施中能使平衡时![]() 增大的是__________(填序号)。
增大的是__________(填序号)。
a.升高温度 b.增大压强 c.充入一定量CO d.再加入一些铁粉
(3)高铁酸钠是一种强氧化剂,具有广泛的用途。
①高铁酸钠与锌组成的高铁电池,不产生污染物,电压高、电量大,是广受欢迎的新型电源,该电池反应为:![]()
![]()
![]()
![]() ,请回答:放电反应为_________(填“反应①”或“反应②”),充电时阳极电极反应式为:_____________________________________。
,请回答:放电反应为_________(填“反应①”或“反应②”),充电时阳极电极反应式为:_____________________________________。
②高铁酸钠是一种新型饮用水净水消毒剂,请简述其净水消毒原理。
| 电解 |
高铁酸钠的化学式为Na2FeO4,按要求回答下列问题:
(1)高铁酸钠主要通过如下反应制取:
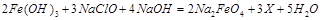 ,则X的化学式为 。
,则X的化学式为 。
(2)高铁酸钠是一种新型净水剂,在水中可以发生如下反应:

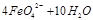
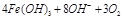 。由此看来,高铁酸钠能够杀菌消毒是因为它具有
性,而能够除去水中悬浮物是因为
。
。由此看来,高铁酸钠能够杀菌消毒是因为它具有
性,而能够除去水中悬浮物是因为
。
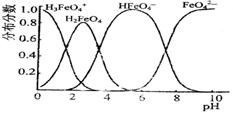
(3)FeO42-在水溶液中的存在形态如图所示。向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为 。
(4)高铁电池是一种新型可充电电池,电解池为碱溶液,其反应式为
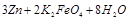
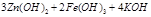 则电池正极材料是 ,充电时电池正极 (填“得”“失”)电子,放电时电池的负极反应式为
。
则电池正极材料是 ,充电时电池正极 (填“得”“失”)电子,放电时电池的负极反应式为
。
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图甲所示:
FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图甲所示:
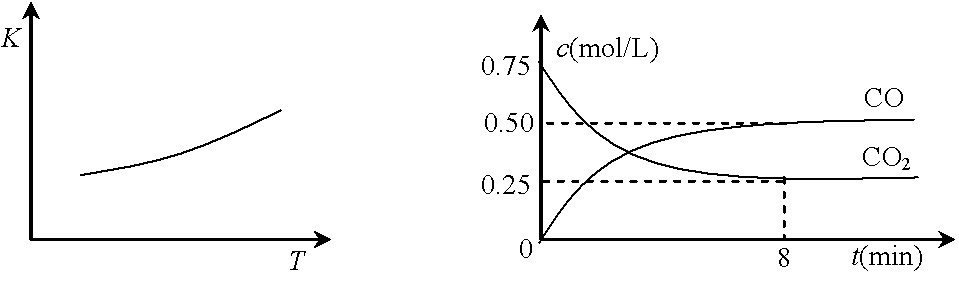
图甲 图乙
⑴该反应的平衡常数表达式K= ▲ 。
⑵一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图乙所示。
8分钟内,CO的平均反应速率v(CO)= ▲ mol/(L·min)。
⑶下列措施中能使平衡时c(CO)/c(CO2)增大的是 ▲ (填序号)。
A.升高温度 B.增大压强
C.充入一定量CO D.再加入一些铁粉
⑷铁的重要化合物高铁酸钠是一种新型饮用水消毒剂,具有氧化能力强、安全性好等优点。
①高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O![]() Na2FeO4+3H2↑,则电解时阳极的电极反应式是 ▲ 。
Na2FeO4+3H2↑,则电解时阳极的电极反应式是 ▲ 。
②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化纳和水,该反应的离子方程式为 ▲ 。
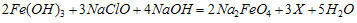 ,则X的化学式为_____________。
,则X的化学式为_____________。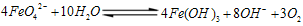 。由此看来,高铁酸钠能够杀菌消毒是因为它具有________性,而能够除去水中悬浮物是因为__________。
。由此看来,高铁酸钠能够杀菌消毒是因为它具有________性,而能够除去水中悬浮物是因为__________。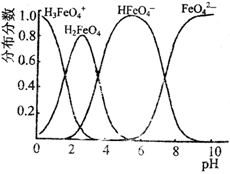
 则电池正极材料是_________,充电时电池正极________(填“得”“失”)电子,放电时电池的负极反应式为___________。
则电池正极材料是_________,充电时电池正极________(填“得”“失”)电子,放电时电池的负极反应式为___________。 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com