
题目列表(包括答案和解析)
- 3 |
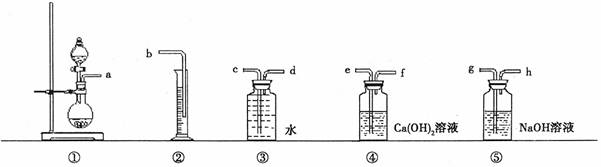
 +4H++3e-═NO↑+2H2O.KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生.
+4H++3e-═NO↑+2H2O.KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生.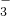 +4H++3e-═NO↑+2H2O.KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生.
+4H++3e-═NO↑+2H2O.KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生.(8分)过碳酸钠和盐酸反应的化学方程式为:2Na2CO4+4HCl=4NaCl+2CO2↑+O2↑+2H2O,商品过碳酸钠中一般都含有Na2CO3,为了测定它的纯度,取一定量的样品和盐酸反应,通过测量产生的氧气的体积,可以计算出过碳酸钠的含量。
(1)根据上图提供的仪器装置,组装一套测定商品过碳酸钠纯度的实验装置,这些装置的连接顺序是(填接口字母): 。
(2)装置④的作用:
。
(3)如果实验时,称取wg样品和过量盐酸反应后,所得氧气的体积(标准状况)为VmL,则计算此样品纯度的表达式为 。
(4)某次实验,称取O.9g样品进行测定。实验室现有50mL,100mL,150mL三种规格的量筒,应选用规格为 的量筒进行实验。
 高氯酸钾广泛用于火箭及热电池业.实验室制取高氯酸钾的原理与苏教版《实验化学》中“硝酸钾晶体的制备”相同,步骤为:称取一定质量的KCl、NaClO4加热溶解,经冷却结晶、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到.
高氯酸钾广泛用于火箭及热电池业.实验室制取高氯酸钾的原理与苏教版《实验化学》中“硝酸钾晶体的制备”相同,步骤为:称取一定质量的KCl、NaClO4加热溶解,经冷却结晶、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到.| NaNO3 | KNO3 | NaCl | KCl | |
| 10°C | 80.5 | 20.9 | 35.7 | 31.0 |
| 100°C | 175 | 246 | 39.1 | 56.6 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com