
题目列表(包括答案和解析)
| |||||||||||||||||||||||||||
(8分)碘是人类必需的生命元素,在人体的生长发育过程中起着重要作用。
(1)人体中碘的重要来源之一是加碘食盐。加碘食盐中的碘元素以碘酸钾(KIO3)的形式存在,其碘元素的化合价是__________。加碘食盐的食用方法是“待食品熟后加入”,说明碘酸钾在受热时易__________。
(2)海带或海苔中含有丰富的碘元素,也是人体碘的一种来源。取海带灰的浸取液加硫酸酸化,再加入少量H2O2溶液与淀粉溶液,溶液变蓝,证明海带中含有碘元素。反应的离子方程式是________。
(3)2012年3月,北京市最新规定食盐中碘含量标准为(18~33)mg/kg。为测定加碘食盐样品的碘含量,某实验小组设计了如下步骤:
I. 用天平准确称取10.0 g食盐样品,加适量蒸馏水使其完全溶解。
II. 用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全。
III. 以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液6.0 mL,恰好反应完全。(已知: )
)
①步骤II中反应的离子方程式是__________。
②步骤III中判断反应恰好完全的现象是__________。
③上述实验样品中碘含量是__________mg/kg,符合北京市规定。
(8分)碘是人类必需的生命元素,在人体的生长发育过程中起着重要作用。
(1)人体中碘的重要来源之一是加碘食盐。加碘食盐中的碘元素以碘酸钾(KIO3)的形式存在,其碘元素的化合价是__________。加碘食盐的食用方法是“待食品熟后加入”,说明碘酸钾在受热时易__________。
(2)海带或海苔中含有丰富的碘元素,也是人体碘的一种来源。取海带灰的浸取液加硫酸酸化,再加入少量H2O2溶液与淀粉溶液,溶液变蓝,证明海带中含有碘元素。反应的离子方程式是________。
(3)2012年3月,北京市最新规定食盐中碘含量标准为(18~33)mg/kg。为测定加碘食盐样品的碘含量,某实验小组设计了如下步骤:
I. 用天平准确称取10.0 g食盐样品,加适量蒸馏水使其完全溶解。
II. 用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全。
III. 以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液6.0 mL,恰好反应完全。(已知: )
)
①步骤II中反应的离子方程式是__________。
②步骤III中判断反应恰好完全的现象是__________。
③上述实验样品中碘含量是__________mg/kg,符合北京市规定。
碘是人类必需的生命元素,在人体的生长发育过程中起着重要作用。
(1)人体中碘的重要来源之一是加碘食盐。加碘食盐中的碘元素以碘酸钾(KIO3)的形式存在,其碘元素的化合价是__________。加碘食盐的食用方法是“待食品熟后加入”,说明碘酸钾在受热时易__________。
(2)海带或海苔中含有丰富的碘元素,也是人体碘的一种来源。取海带灰的浸取液加硫酸酸化,再加入少量H2O2溶液与淀粉溶液,溶液变蓝,证明海带中含有碘元素。反应的离子方程式是__________。
(3)2012年3月,北京市最新规定食盐中碘含量标准为(18~33)mg/kg。为测定加碘食盐样品的碘含量,某实验小组设计了如下步骤:
I. 用天平准确称取10.0 g食盐样品,加适量蒸馏水使其完全溶解。
II. 用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全。
III. 以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液6.0 mL,恰好反应完全。(已知:![]() )
)
①步骤II中反应的离子方程式是__________。
②步骤III中判断反应恰好完全的现象是__________。
③上述实验样品中碘含量是__________mg/kg,符合北京市规定。
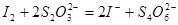 )
)湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com