铝是地壳中含量最高的金属元素,其单质及化合物在生产生活中的应用日趋广泛.
(1)在19世纪时,铝是一种珍贵的金属.人们最初得到的铝粒如同珍宝,它的价格同黄金相当.1827年,德国化学家维勒用金属钾与无水氯化铝反应而制得了金属铝.用钾与无水氯化铝反应制铝而不用氯化铝溶液的理由是
.
(2)冶炼金属铝,第一步先出氧化铝制备无水氯化铝.已知:
2Al(s)+3Cl
2(g)═2AlCl
3(s)△H=-1390.8kJ/mol
4Al(s)+3O
2(g)═2Al
2O
3(s)△H=-3339.6kJ/mol
2C(s)+O
2(g)═2CO(g)△H=-221.0kJ/mol
AlCl
3(s)═AlCl
3(g)△H=+akJ/mol(a>0)
则Al
2O
3(s)+3Cl
2(g)+3C(s)═2AlCl
3(g)+3CO(g)的△H=
kJ/mol
(3)LiAlH
4既是金属储氢材料又是有机合成中的常用试剂,遇水能得到无色溶液并剧烈分解释放出H
2,写出该反应的化学方程式
;LiAlH
4与乙醛作用生成乙醇,在该反应中LiAlH
4作
剂.(填“氧化”或“还原”)
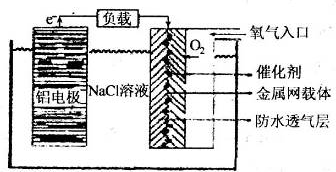
(4)铝电池性能优越,铝--空气电池以其环保、安全而受到越来越多的关注,其原理如图所示.该电池的总反应化学方程式为
;电池中NaCl的作用是
.以该电池为电源,用惰性电极电解100g 8%的Na
2SO
4溶液,当电解到溶质的质量分数为12.5%时停止电解,则电解过程中,生成的气体在标准状况下的体积共为
L.


