
题目列表(包括答案和解析)
A.Ba2++SO![]() ===BaSO4↓
===BaSO4↓
B.Al3++3OH-===Al(OH)3↓
C.Al3++4OH-===AlO![]() +2H2O
+2H2O
D.2Al3++3SO![]() +3Ba2++6OH-===3BaSO4↓+2Al(OH)3↓
+3Ba2++6OH-===3BaSO4↓+2Al(OH)3↓
E.Al3++2SO![]() +2Ba2++3OH-===2BaSO4↓+Al(OH)3↓
+2Ba2++3OH-===2BaSO4↓+Al(OH)3↓
F.Al3++2SO![]() +2Ba2++4OH-===2BaSO4↓+AlO
+2Ba2++4OH-===2BaSO4↓+AlO![]() +2H2O
+2H2O
请回答:
(1)Al3+完全沉淀时的离子方程式为_________________。(只选一个填写字母,下同)
(2)SO![]() 完全沉淀时的离子方程式为_________________________。
完全沉淀时的离子方程式为_________________________。
(3)沉淀达到最大量时,沉淀的总和为__________ mol,此时的离子方程式为______________。
(4)在硫酸钾、硫酸铝和明矾组成的混合溶液中,若c(SO![]() )为a mol·L-1,当滴加完等体积的b mol·L-1 KOH溶液时,反应过程中生成的沉淀恰好完全溶解,则原混合溶液中K+的物质的量浓度为__________ mol·L-1(用a、b表示)。
)为a mol·L-1,当滴加完等体积的b mol·L-1 KOH溶液时,反应过程中生成的沉淀恰好完全溶解,则原混合溶液中K+的物质的量浓度为__________ mol·L-1(用a、b表示)。
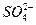 ,向含a mol KAl(SO4)2的溶液中,逐滴加入Ba(OH)2溶液,过程中可能存在以下多个离子方程式
,向含a mol KAl(SO4)2的溶液中,逐滴加入Ba(OH)2溶液,过程中可能存在以下多个离子方程式A.Ba2++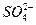 ====BaSO4↓ ====BaSO4↓ |
| B.Al3++3OH?====Al(OH)3↓ |
C.Al3++4OH-==== 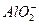 +2H2O +2H2O |
D.2Al3++3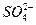 +3Ba2++6OH-====3BaSO4↓+2Al(OH)3↓ +3Ba2++6OH-====3BaSO4↓+2Al(OH)3↓ |
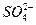 +2Ba2++3OH-====2BaSO4↓+Al(OH)3↓
+2Ba2++3OH-====2BaSO4↓+Al(OH)3↓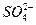 +2Ba2++4OH-====2BaSO4↓+
+2Ba2++4OH-====2BaSO4↓+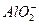 +2H2O
+2H2O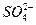 完全沉淀时的离子方程式为_________。
完全沉淀时的离子方程式为_________。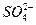 )为a mol·L-1,当滴加完等体积的b mol·L-1 KOH溶液时,反应过程中生成的沉淀恰好完全溶解,则原混合溶液中K+的物质的量浓度为 mol·L-1(用a、b表示)。
)为a mol·L-1,当滴加完等体积的b mol·L-1 KOH溶液时,反应过程中生成的沉淀恰好完全溶解,则原混合溶液中K+的物质的量浓度为 mol·L-1(用a、b表示)。
| (m-132n) |
| 42 |
| (m-132n) |
| 42 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com