
题目列表(包括答案和解析)
| A(短周期) | B(短周期) | C | D(短周期) |
| 原子最外层上p电子数等于次外层电子数 | 原子最外层有两个未成对电子,其单质为人类生存必须物质 | 单质为生活中常见的金属材料,有紫红色金属光泽 | 单质是常见的半导体材料,广泛应用于IT行业 |
| ||
| ||
| ||
| ||
(13分)铁和铁的化合物在工业生产和日常生活中都有广泛的用途。
(1)在定向爆破中,常利用氧化铁与铝反应放出的热量来切割钢筋,该反应的化学方程式为__。
(2)已知:2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s)? △H=+468.2 kJ·mol-1
C(s)+O2(g)=CO2(g) △H=-393.5 kJ·mol-1。
则Fe(s)与O2 (g)反应生成Fe2 O3 (s)的热化学方程式为______________________。
(3)可用KMnO4溶液滴定Fe2+的浓度,反应的离子方程式如下:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
①KMnO4溶液应盛放在_____滴定管中;
②判断达到滴定终点的现象是_____;
③用硫酸酸化的0.020 00 mol·L-1。KMnO4溶液滴定某FeSO4溶液至终点,实验数据记录如下表:
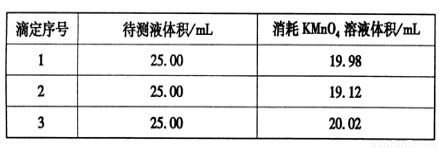
请分析数据并计算,该FeSO4溶液的物质的量浓度为_____。
(4)新型纳米材料ZnFe2Ox,可用于除去工业废气中的某些氧化物。制取新材料和除去废气的转化关系如下图:
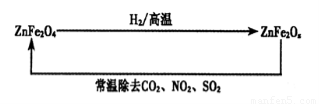
①已知ZnFe2O4与H2反应的物质的量之比为2:1,则ZnFe2Ox中x=_____;
②用ZnFe2Ox除去SO2的过程中,氧化剂是_____。
1991年美国的B,M,Trost首次提出了化学反应的原子经济性的概念。原子经济性可以用原子利用率来衡量。
原子利用率(%)=![]()
KOH是一种重要的化工原料,广泛应用于KMnO4、K2CO3的生产。
(1)某同学用KOH、CO2为原料,以提高原子利用率为原则,在实验室制取K2CO3固体。所设计的两套方案分别为:
①方案一:
先配制KOH溶液,然后通过过量CO2,再经过蒸发结晶、灼烧得到K2CO3固体。在蒸发结晶过程中用玻璃棒搅拌的目的是
。
②方案二:
第一步骤为:配制KOH溶液并将其等分于两烧杯中。
第二步骤作为:向其中一烧杯中通入 ,反应的化学方程式为 。
将两溶液混合,再经蒸发结晶、灼烧便可得到K2CO3固体。
③试从原子经济性的角度评价上述实验方案。
。
(2)工业上利用KOH和MnO2为原料制取KMnO4。主要生产过程分两步进行:
第一步将MnO2和固体KOH粉碎,混合均匀,在空气中加热之熔化,并连续搅拌以制取K2MnO4;第二步为电解K2MnO4的浓溶液制取KMnO4。
①第一步反应的化学方程式为 。
②电解K2MnO4的浓溶液时,电解池中阴极的实验现象为 。
③用KOH、MnO2等为原料制取K2MnO4过程中的原子利用率为 。
(15分)“材料”的发现和使用往往会极大地推动生产、生活的发展,一些材料的出现甚至具有里程碑式划时代的意义。请你回答以下问题:
⑴无机非金属材料。高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾
引起计算机的一场“革命”。这种材料可以按下列方法制备:
![]()
①写出步骤①的化学方程式 。
②步骤②经过冷凝得到的SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点57.6℃)和HCl(沸点—84.7℃),提纯SiHCl3的主要化学操作的名称是 ;SiHCl3和SiCl4一样遇水可发生剧烈水解,已知SiHCl3水解会生成两种气态产物,请写出其水解的化学方程式 。
③请写出二氧化硅与氢氟酸反应的化学方程式 。
⑵磁性材料。这种材料一般含有铁元素,铁是用途最为广泛的金属,也较为活泼,所以从它的使用开始
就不断实施着对它的防护。最常见的铁制品腐蚀就是电化学腐蚀,请出最为普遍的电化学腐蚀的负极反
应式 。
⑶激光材料。我国是激光技术先进的国家,红宝石(Al2O3)是最早用于产生激光的材料,它是一种两性
氧化物,请用离子方程式加以说明: , 。
⑷纳米材料。胶体是一种物质以“纳米”颗粒的形式分散到另一种物质里形成的分散系,胶体粒子的直经大约是 ,三氯化铁溶液可以加速伤口止血,请简述原因
。
⑸高分子材料。可以分成无机高分子材料和有机高分子材料。一种新型高效净水剂[AlFe(OH)nCl6—n]m就属于无机高分子材料,广泛应用于生活用水和工业污水处理,其中铁元素的化合价为 。
| ①C |
| 高温 |
| ②HCl |
| ℃300 |
| ③过量H2 |
| 1000℃~1100℃ |
| ||
| ||
| 催化剂 |
| 加热 |
| 催化剂 |
| 加热 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com