
题目列表(包括答案和解析)
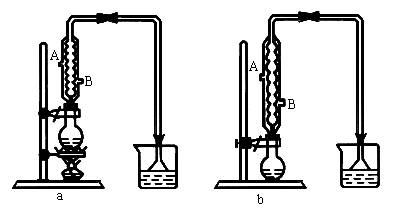
(1)该实验应选择图中的a还是b装置?
___________________________________________________
(2)反应装置中的烧瓶应选择下列哪种规格最合适?
__________________________
A.50 mL B.100mL C.150mL D.250mL
(3)冷凝管中的冷凝水的流向应是_____________。
A.A进B出 B.B进A出 C.从A进或B进均可
(4)由NaBr浓H2SO4和乙醇共热制备C2H5Br反应的化学方程式为_________________
________________。可能发生的副反应为:_____________________________________。
(5)上述实验完成后,需要将烧瓶中的有机物蒸馏出来,所得馏出液中含有_____________________________________________________________。
(6)从棕黄色的粗溴乙烷制取无色的溴乙烷应加入的试剂是__________________,必须使用的仪器是_______________________________。
(7)本实验的产率为60%,则可制取溴乙烷______________g。
(8)为除去溴乙烷中残留的少量水,可选用无水CaCl2作干燥剂,并蒸馏。为证明最终得到的产品一溴乙烷中含有溴元素,可采取的实验方法是_____________________________
__________________________________________________。
实验室可用NaBr、浓H2SO4和乙醇为原料制备溴乙烷,已知反应物的用量:0.3mol NaBr(s);0.25mol乙醇;36mL浓硫酸(溶质分数为98%,密度1.84g×mL-1);25mL水,其中乙醇的密度为0.80g×cm-3,回答下列问题。

(1)该实验应选择图中的a还是b装置?
___________________________________________________
(2)反应装置中的烧瓶应选择下列哪种规格最合适?
__________________________
A.50 mL B.100mL C.150mL D.250mL
(3)冷凝管中的冷凝水的流向应是_____________。
A.A进B出 B.B进A出 C.从A进或B进均可
(4)由NaBr浓H2SO4和乙醇共热制备C2H5Br反应的化学方程式为_________________
________________。可能发生的副反应为:_____________________________________。
(5)上述实验完成后,需要将烧瓶中的有机物蒸馏出来,所得馏出液中含有_____________________________________________________________。
(6)从棕黄色的粗溴乙烷制取无色的溴乙烷应加入的试剂是__________________,必须使用的仪器是_______________________________。
(7)本实验的产率为60%,则可制取溴乙烷______________g。
(8)为除去溴乙烷中残留的少量水,可选用无水CaCl2作干燥剂,并蒸馏。为证明最终得到的产品一溴乙烷中含有溴元素,可采取的实验方法是_____________________________
__________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com