
题目列表(包括答案和解析)
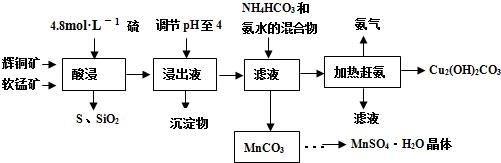
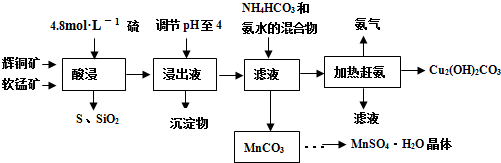
二氧化钛是一种不溶于稀酸的物质,常用于制取金属钛。某种金红石矿石的主要成分是TiO2,含有Fe2O3和Al2O3杂质。一研究性学习小组设计如下方案制备金属钛,并得到其它副产品。

(1)已知Fe(OH)3、Al(OH)3,开始沉淀的pH数据(见下表)
氢氧化物 | Fe(OH)3 | A1(OH)3 |
开始沉淀pH | 1.5 | 3.3 |
向溶液I中滴加NaOH溶液,并调溶液pH,若开始只得到一种沉淀,该沉淀是 ,应控制pH的范围是 ,反应的离子方程式是 ;
(2)向溶液Ⅱ中“继续加适量NaOH溶液”,若操作不当会减少滤渣Ⅲ的质量,请你设计另一种方案代替向溶液Ⅱ中“继续加适量NaOH溶液”的方案,该方案是 ,反应的离子方程式是 ;
(3)已知:①CO2(g)==C(s)+O2(g); △H =393.5 kJ?mol-l
②CO(g)+ O2(g)==CO2(g); △H =-283 kJ?mol-l
③TiO2(s)+2Cl2(g)==TiCl4(s)+O2(g);△H =141 kJ?mol-l
写出TiO2与Cl2+C反应的热化学方程式 。
(4)若经过多步反应后制得b g金属钛,则金红石矿石中TiO2的质量分数为
|
一定量的锌与100 mL 1.85 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体A 1.5 mol.将反应后的溶液稀释至1 L,测得溶液的pH=1,则下列叙述中错误的是 | |
A. |
气体A为SO2和H2的混合物 |
B. |
气体A中SO2与H2的体积之比为4∶1 |
C. |
反应中共消耗97.5 g Zn |
D. |
反应中共转移3 mol电子 |
硫酸铜是一种应用极其广泛的化工原料.铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发.结晶得到硫酸铜晶体(装置如图1、2所示).

(1)图1中A仪器的名称________,烧瓶中发生的离子反应方程式为:________
(2)图2是图1的改进装置,其优点有:
①________________;②________________.
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:以空气为氧化剂.将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应.
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应.向反应液中加FeSO4或Fe2(SO4)3,即发生反应.反应完全后向其中加物质甲调节pH到3~4,产生Fe(OH)3沉淀,过滤、蒸发、结晶,滤渣作催化剂循环使用.(已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3、7、6、4.)
请回答下列问题:
①方案1中的B仪器名称是________.
②方案2中甲物质是________(填字母序号).
a.CaO b.CuCO3 c.CaCO3 d.NH3·H2O
第二组:过氧化氢为氧化剂法
将3.2 g铜丝放到45 mL 1.5 mol/L的稀硫酸中,控温在50℃.加入18 mL 10%的H2O2,反应0.5小时后,升温到60℃,持续反应1小时后,过滤、蒸发结晶、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 10.6 g.
请回答下列问题:
③加热时温度不宜过高的原因是________________,晶体采用酒精淋洗的优点是________________.
④上述两种氧化法中,更符合绿色化学理念的是________(填“第一组”或“第二组”),理由是_________、_________、_________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com