
题目列表(包括答案和解析)
铁及其化合物在日常生活、生产中应用广泛.研究铁及其化合物的应用意义重大.
I.水体的净化和污水的处理与铁及其化合物密切相关.
(1)自来水厂常用高铁酸钠(Na2FeO4)改善水质.简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理 .
(2)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
|
沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
|
开始沉淀 |
2.3 |
7.5 |
3.4 |
|
完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
①写出反应I中主要发生的氧化还原反应的离子方程式 .
②加入少量NaHCO3的目的是调节溶液pH,应控制pH的范围为 .
③在实际生产中,反应II常同时通入O2以减少NaNO2的用量,若通入5.6L O2(标准状况),则相当于节约NaNO2的质量为 g.
④碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子.该水解反应的离子方程式为 .
II铁的化合物也是制备高能锂电池的重要原料.已知磷酸亚铁锂电池总反应为:FePO4+Li LiFePO4,电池中的固体电解质可传导Li+.试写出该电池充电时的阳极反应式
.
LiFePO4,电池中的固体电解质可传导Li+.试写出该电池充电时的阳极反应式
.
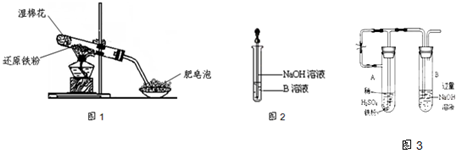
小明很喜欢化学实验课,今天要学习“探究铁及其化合物的氧化性或还原性”.
(1)实验前小明预测说:
Fe2‘肯定既有还原性又有氧化性.你认为他预测的依据是:________(2)小明欲用实验证明他的预测.实验室提供了下列试剂:3%的
H2O2溶液、锌粒、铜片、0.1mol·Ll FeCl2溶液、KSCN溶液、新制氯水.①若小明计划在0.
1 mol·L1 FeCl2溶液滴入新制氯水,探究Fe.的还原性,你预计可能发生的反应和现象是:(写离子方程式)、溶液由浅绿色变________色.②实验中,小明发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验
Fe2,被氧化的产物Fe3+的存在以获取证据.你认为可选________滴入小明所得的混合液中,并通过溶液出现________色的现象,证明小明的观点和实验方案都是正确的.③对于证明Fe2,具有氧化性,小明认为金属单质都具有还原性,并分别将铜片、锌粒投入
FeCL溶液中,结果铜片没变化,锌粒逐渐变小.由此说明三种金属的还原性由强至弱的顺序为________.(3)
小明分析H2O2中氧元素显-1价(中间价),并提出疑问:H2O2与FeCl2的反应时,Fe2t还作氧化剂吗?①请你为小明梳理相关问题:若Fe在反应中表现出氧化性应转化成________(填微粒符号,下同),若
Fe2t在反应中表现出还原性应转化成________.②实际上
Fe2+还原性较强,实验室的FeCl2溶液常因氧化而变质.除杂的方法是:________,相关反应的离子方程式:________.| A、FeCl2不能由化合反应制取 | B、铁与水蒸气在高温下反应产物为Fe2O3和H2 | C、除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤 | D、Fe(NO3)2溶液中加入稀硫酸,没有任何变化 |
| A、Fe3O4是一种红棕色粉末,俗称铁红 | B、Fe(OH)2为白色固体,能在空气中稳定存在 | C、除去FeCl2溶液中的FeCl3杂质,可以向溶液中加入过量的铁粉,然后过滤 | D、Fe2(SO4)3溶液遇到KSCN溶液产生血红色沉淀 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com