
题目列表(包括答案和解析)
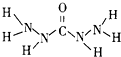 化合物A是近年来采用的锅炉水添加剂,其结构简式如图,A能除去锅炉水中溶解的氧气,下列说法正确的是( )
化合物A是近年来采用的锅炉水添加剂,其结构简式如图,A能除去锅炉水中溶解的氧气,下列说法正确的是( )| A、A分子中所有原子共平面 | B、A分子中N的化合价为-3价 | C、A分子中含有10个σ键和1个π键 | D、1mol A在足量O2中燃烧生成CO2、N2、H2O的物质的量之比为1:2:3 |
(10分).近年来,江苏省酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
⑴有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,流程如下: ( I )将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液。(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸。(III)将盐酸加入NaHSO3溶液中得SO2气体回收,生成的NaCl循环利用。
① 写出步骤(I)反应的化学方程式:
② 写出步骤(III)反应的离子方程式:
⑵还有学者提出利用 Fe 2十、Fe3十等离子的催化作用,常温下将SO2氧化成SO42一而实现SO2的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO42一的转化率。
① 该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是(填序号) 。(参考:还原性SO2 > I- >Br->Cl-)
A.碘的淀粉溶液 B.酸性高锰酸钾溶液
C.氢氧化钠溶液 D.氯化钡溶液
② 若上述实验是在标准状况下进行的,X是已知体积和物质的量浓度的溶液,欲测定转化器中SO2氧化成SO42一的转化率,已知气体流速,还需测定的数据是 和加入盐酸酸化的氯化钡溶液后生成沉淀的质量。
(3)为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2。该方法涉及到的化学反应为:SO2+2CO=2CO2+Sx 、
CO+Sx=COS、2COS+SO2=2CO2+
Sx 。其中COS中“C”化合价为 。
(4)若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在消化细菌的作用下将NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后加入甲醇(CH3OH),NO3-和甲醇转化为两种无毒气体。请写出加入甲醇后反应的离子方程式 。
(10分).近年来,江苏省酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
⑴有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,流程如下: ( I )将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液。(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸。(III)将盐酸加入NaHSO3溶液中得SO2气体回收,生成的NaCl循环利用。
① 写出步骤(I)反应的化学方程式:
② 写出步骤(III)反应的离子方程式:
⑵还有学者提出利用 Fe 2十、Fe3十等离子的催化作用,常温下将SO2氧化成SO42一而实现SO2的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO42一的转化率。

① 该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是(填序号) 。(参考:还原性SO2 > I- >Br->Cl-) 
A.碘的淀粉溶液 B.酸性高锰酸钾溶液
C.氢氧化钠溶液 D.氯化钡溶液
② 若上述实验是在标准状况下进行的,X是已知体积和物质的量浓度的溶液,欲测定转化器中SO2氧化成SO42一的转化率,已知气体流速,还需测定的数据是 和加入盐酸酸化的氯化钡溶液后生成沉淀的质量。
(3)
为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2。该方法涉及到的化学反应为:SO2+2CO=2CO2+ Sx 、
Sx 、
CO+ Sx=COS、2COS+SO2=2CO2+
Sx=COS、2COS+SO2=2CO2+ Sx 。其中COS中“C”化合价为 。
Sx 。其中COS中“C”化合价为 。
(4)若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在消化细菌的作用下将NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后加入甲醇(CH3OH),NO3-和甲醇转化为两种无毒气体。请写出加入甲醇后反应的离子方程式 。
(11分)离于液体是常温下呈液态的离子化合物,已知品种几十种,是一类“绿色溶剂”。据2002年4月的一篇报道,最近有人进行了用离子液体溶解木浆纤维素的实验,结果如下表所示:向溶解了纤维素的离子液体添加约1.0%(质量)的水,纤维素会从离子液体中析出而再生;再生纤维素跟原料纤维素的聚合度相近;纤维素分子是葡萄糖(C6H12O6)的缩合高分子,可粗略地表示如下图,它们以平行成束的高级结构形成纤维;葡萄糖缩合不改变葡萄糖环的结构;纤维素溶于离子溶液又从离子液体中析出,基本结构不变。
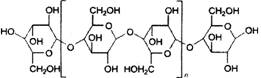 n=400~1000
n=400~1000 
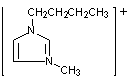
表中[C4min]Cl是1-(正)丁基-3-甲基咪唑正一价离子的代号,“咪唑”的结构如右上图所示。
回答如下问题:
1.在下面的方框中画出以[C4min]+为代号的离子的结构式。
表木浆纤维在离子液体中的溶解性 | ||
离子液体 | 溶解条件 | 溶解度(质量%) |
[C4min]Cl | 加热到100℃ | 10% |
[C4min]Cl | 微波加热 | 25%,清澈透明 |
[C4min]Br | 微波加热 | 5~7% |
[C4min]SCN | 微波加热 | 5~7% |
[C4min][BF4] | 微波加热 | 不溶解 |
[C4min][PF4] | 微波加热 | 不溶解 |
[C6min]Cl | 微波加热 | 5% |
[C8min]Cl | 微波加热 | 微溶 |
2.符号[C6min]+和[C8min]+里的C6和C8代表什么?答: 和 。
3.根据上表所示在相同条件下纤维素溶于离子液体的差异可见,纤维素溶于离子液体的主要原因是纤维素分子与离子液体中的 之间形成了 键;纤维素在[C4min]Cl、[C4min]Br、[C4min][BF4]中的溶解性下降可用 来解释,而纤维素在[C4min]Cl、[C6min]Cl和[C8min]Cl中溶解度下降是由于 的摩尔分数 。
4.在离子液体中加入水会使纤维素在离子液体里的溶解度下降,可解释为: 。
 5.假设在[C4min]Cl里溶解了25%的聚合度n=500的纤维素,试估算,向该体系添加1.0%(质量)的水,占整个体系的摩尔分数多少?假设添水后纤维素全部析出,析出的纤维素的摩尔分数多大?
5.假设在[C4min]Cl里溶解了25%的聚合度n=500的纤维素,试估算,向该体系添加1.0%(质量)的水,占整个体系的摩尔分数多少?假设添水后纤维素全部析出,析出的纤维素的摩尔分数多大?

(1)从表中可以看出,除H外,其余非金属元素原子_________(填序号)
a.最外层电子数都大于4 b.最外层电子数都大于电子层数
(2)以下方法可以比较S、Cl非金属性强弱的是_________(填序号,答案可能不止一个)
a.分别测定Na2S溶液和NaCl溶液的pH
b.将Fe分别与S、Cl2反应,分析产物中Fe的化合价
c.将H2S通入氯水中,观察到有淡黄色固体析出:H2S + Cl2 → 2HCl + S↓
(3)以下关于元素的用途中叙述正确的是__________(填序号,答案可能不止一个)
a.P、S、Cl等元素的化合物常用来制取农药 b.Si、Ge可用于制半导体材料
c.钨是熔点最高的金属,可与钠制成合金
(4)近期,有科学家宣布,他们通过分析182 72Hf和182 74W的相对含量,发现月球的产生起码比地球早700万年。这里的“182”是指原子的_____________(填序号)。
a.质子数 b.中子数 c.质量数 d.相对原子质量
(5)美俄科学家2006年10月5日宣布他们制得了118号元素。试分析,若制得117号元素(位置见表),按元素周期表中金属与非金属的分区,它应是一种________(选填“金属”、“非金属”)元素,写出117号元素最外层电子排布式___________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com