
题目列表(包括答案和解析)
| 实验操作 | 实验现象 |
| 1.用砂纸擦后的镁带与沸水反应,再向反应后溶液中滴加酚酞 | (A)浮于水面,熔成一个小球,在水面上无定向移 动,随之消失,溶液变红色 (B)产生气体,可在空气中燃烧,溶液变成浅红色 (C)反应不十分强烈,产生的气体可以在空气中燃 烧 (D)剧烈反应,产生可燃性气体 (E)溶液的碱性逐渐减弱 (F)生成淡黄色沉淀 |
| 2.向新制的H2S饱和溶液中滴加新制的氯水 | |
| 3.钠与滴有酚酞试液的冷水反应 | |
| 4.镁带与2mol.L-1的盐酸反应 | |
| 5.铝条与2mol.L-1的盐酸反应 | |
| 6.测定 0.1mol/L的Na2SiO3、Na3PO4、Na2SO4溶液的pH |
| 实验 编号 |
KClO3(g) | 氧化物 | 产生气体(mL) | 耗时(s) | ||
| 化学式 | 质量(g) | 回收 | (已折算到标况) | |||
| 1 | 0.60 | - | - | - | 10 | 480 |
| 2 | 0.60 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
| 3 | 0.60 | CuO | 0.20 | 90% | 67.2 | 79.5 |
| 4 | 0.60 | Fe2O3 | 0.20 | 90% | 67.2 | 34.7 |
| 5 | 0.60 | Cr2O3 | 0.20 | 异常 | 67.2 | 188.3 |
|
实验 编号 |
KClO3(g) | 氧化物 |
产生气体(mL) (已折算到标况) |
耗时(s) | ||
| 化学式 | 质量(g) | 回收 | ||||
| 1 | 0.60 | - | - | - | 10 | 480 |
| 2 | 0.60 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
| 3 | 0.60 | CuO | 0.20 | 90% | 67.2 | 79.5 |
| 4 | 0.60 | Fe2O3 | 0.20 | 90% | 67.2 | 34.7 |
| 5 | 0.60 | Cr2O3 | 0.20 | 异常 | 67.2 | 188.3 |
学习了元素周期律的有关知识后,同学们设计了多个实验在实验室探究同周期及同主族元素性质的递变规律。甲组同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族和同周期元素非金属性强弱比较的实验研究;乙组同学设计了如图2装置来验证卤素单质氧化性的相对强弱的实验。

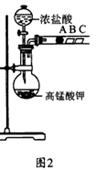
(1) 甲组同学设计实验的依据是 ;写出选用物质的名称:A 、B 、C ;烧杯C中发生反应的离子方程式 ,通过实验得出的结论:元素非金属性强弱顺序为 。
(2) 乙组同学实验过程如下:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕色时,关闭活塞a。
Ⅳ………
①验证氯气的氧化性强于碘的实验现象是 。
②B中溶液发生反应的离子方程式是 。
③为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是
。
④过程Ⅲ实验的目的是 。
⑤氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下 , 能力逐渐减弱。
学习了元素周期律后,同学们对第四周期过渡元素氧化物产生了浓厚的兴趣。是否只有二氧化锰能催化氯酸钾受热分解?氧化铁、氧化铜、氧化铬等对氯酸钾的受热分解有没有催化作用?对此他们进行了实验探究。请你根据要求完成下列部分实验报告。
Ⅰ.实验仪器及试剂:
实验仪器:带铁夹的铁架台、带橡皮塞的导管、量气装置、过滤装置、电子天平、药匙、________、________、________等。
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾 Ⅱ. 实验步骤:略
Ⅲ. 实验数据:
|
实验编号 |
KClO3(g) |
氧化物 |
产生气体(mL) |
耗时(s) |
||
|
化学式 |
质量(g) |
回收 |
(已折算到标况) |
|||
|
1 |
0.60 |
- |
- |
- |
10 |
480 |
|
2 |
0.60 |
MnO2 |
0.20 |
90% |
67.2 |
36.5 |
|
3 |
0.60 |
CuO |
0.20 |
90% |
67.2 |
79.5 |
|
4 |
0.60 |
Fe2O3 |
0.20 |
90% |
67.2 |
34.7 |
|
5 |
0.60 |
Cr2O3 |
0.20 |
异常 |
67.2 |
188.3 |
Ⅳ. 实验讨论:
(1) 在氧化物的回收过程中,要进行过滤操作,所用的玻璃仪器是玻璃棒、_________、________
(2)实验编号3的实验中KClO3的分解率为_________________%(保留一位小数)
(3) 在用Cr2O3做研究实验时,发现有黄绿色刺激性气味的气体产生,同时绿色的混合物变成了橘黄色。该刺激性气体是________(填分子式),可用_______________试纸检验。上述异常现象产生的原因是______________________________________。
Ⅴ.实验结论:________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com