
题目列表(包括答案和解析)
(5分)晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si + 3HCl(g) SiHCl3 + H2(g)
SiHCl3 + H2(g)
③SiHCl3与过量H2在1000-1100℃反应制得纯硅:
SiHCl3(g)+ H2(g) Si(s)+ 3HCl(g)
Si(s)+ 3HCl(g)
已知SiHCl3能与H2O剧烈反应,且在空气中易自燃。
用SiHCI3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去)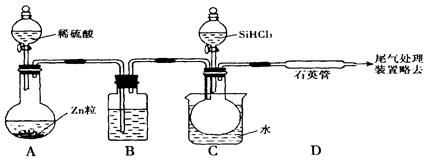
(1)装置B中的试剂是
(2)反应一段时间后,装置D中观察到的现象是 ,装置D不能采用普通玻璃管的原因是 。
(3)为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 。
(4)为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂是 。(填写字母代号)
a.碘水 b.氯水 c. NaOH溶液 d. KSCN溶液 e. Na2SO3溶液
(5分)晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3 :Si + 3HCl(g) SiHCl3 + H2(g)
SiHCl3 + H2(g)
③SiHCl3与过量H2在1000-1100℃反应制得纯硅:
SiHCl3(g) + H2(g) Si(s)+ 3HCl(g)
Si(s)+ 3HCl(g)
已知SiHCl3能与H2O剧烈反应,且在空气中易自燃。
用SiHCI3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去)
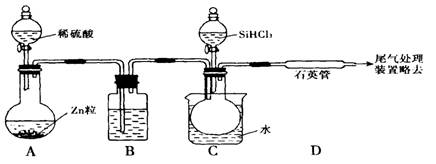
(1)装置B中的试剂是
(2)反应一段时间后,装置D中观察到的现象是 ,装置D不能采用普通玻璃管的原因是 。
(3)为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 。
(4)为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂是 。(填写字母代号)
a.碘水 b.氯水 c. NaOH溶液 d. KSCN溶液 e. Na2SO3溶液
 SiHCl3 + H2(g)
SiHCl3 + H2(g) Si(s)+ 3HCl(g)
Si(s)+ 3HCl(g)
| 元素 | T | X | Y | Z | W |
| 原子半径(nm) | 0.037 | 0.075 | 0.099 | 0.102 | 0.143 |
| 最高或最低化合价 | +1 | +5 -3 |
+7 -1 |
+6 -2 |
+3 |



 NH3?H2O
NH3?H2O NH4++OH-,NaOH溶于水电离出OH-,使平衡向左移动,且溶解时放出热量,使NH3的溶解度减小
NH4++OH-,NaOH溶于水电离出OH-,使平衡向左移动,且溶解时放出热量,使NH3的溶解度减小 NH3?H2O
NH3?H2O NH4++OH-,NaOH溶于水电离出OH-,使平衡向左移动,且溶解时放出热量,使NH3的溶解度减小
NH4++OH-,NaOH溶于水电离出OH-,使平衡向左移动,且溶解时放出热量,使NH3的溶解度减小①25℃,难溶电解质的溶度积常数:Ksp[CaF2]=1.5×10-10,Ksp[Mg(OH)2]=1.8×10-11,Ksp [Cu(OH)2]=2.2×10-20
②弱电解质在水溶液中存在电离常数:例如一元弱酸HA![]() H++A-,其电离常数表达式 Ka= c(H+)·c (A-)/ c (HA)(各浓度为平衡时浓度)。该常数与浓度、压强无关,只是温度的函数。25℃,醋酸的Ka=1.76×10-5
H++A-,其电离常数表达式 Ka= c(H+)·c (A-)/ c (HA)(各浓度为平衡时浓度)。该常数与浓度、压强无关,只是温度的函数。25℃,醋酸的Ka=1.76×10-5
③25℃时,2.0×10-3mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到
c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
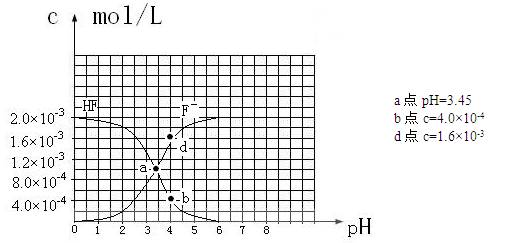
请根据以上信息回答下列问题:
(1)25℃时,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为 。
(2)25℃时,HF电离常数的数值Ka![]() ,列式并说明得出该常数的理由 。
,列式并说明得出该常数的理由 。
(3)25℃时,向浓度均为0.1 mol·L-1的相同体积的HF和醋酸两种溶液中分别加入相同的足量锌粒,初始时产生氢气的速率关系为 (填“>”“=”或“<”,下同)。反应结束后,产生氢气的物质的量的关系为 ,两溶液中c (F-) c (CH3COO-)。
(4)25℃时,4.0×10-3mol·L-1HF溶液与4.0×10-4 mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com