
题目列表(包括答案和解析)
| m |
| 233 |
| V |
| 200 |
| m |
| 233 |
| V |
| 200 |
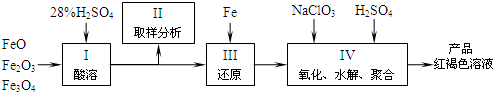

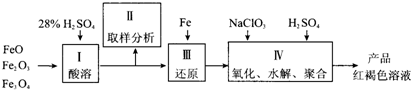
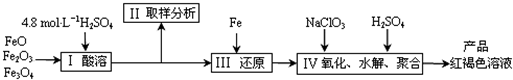
铁及其化合物有重要用途,如聚合硫酸铁[Fe2(0H)n(S04)3-n/2]m是一种新型高效的水 处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设 计如下方案制备上述两种产品:

请回答下列问题:
(1)若A为H20(g),可以得到Fe304,写出H2O的电子式:_______.
(2)若B为NaC103与稀硫酸,写出其氧化Fe2+的离子方程式(还原产物为Cl-): ____。
(3)若C为KNO3和KOH的混合物,写出其与Fe2O3加热共融制得高铁酸鉀的化学方程式 并配平:

(4)为测定溶液I中铁元素的总含量,实验操作:准确量取20.00mL溶液I于带塞锥形瓶 中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用0.1000mol.L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:
①写出滴定选用的指示剂______,滴定终点观察到的现象______:
②溶液丨中轶元素的总含量为______g.L-1。若滴定前溶液中H202没有除尽,所测定的铁元 素的含量将会______ (填“偏高” “偏低” “不变”)。
(5)设计实验方案,检验溶液I中的Fe2+和Fe3+ ______。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com