
题目列表(包括答案和解析)
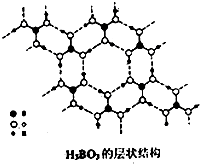 CrO3、NaBH4常用于醛、酮与醇的相互转化,由硼酸[H2BO3或B(OH)2]可以合成NaBH4.
CrO3、NaBH4常用于醛、酮与醇的相互转化,由硼酸[H2BO3或B(OH)2]可以合成NaBH4.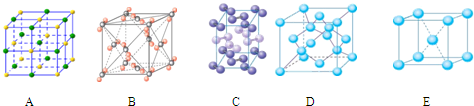
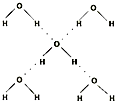
| 键型 | 键能 (kJ/mol) |
键长 (pm) |
分子 | 键角 | 物质 | 熔点(℃) | 沸点(℃) |
| H-C | 413 | 109 | 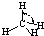 |
109.5° | 甲烷 | -183.7 | -128.0 |
| H-N | 391 | 101 | 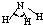 |
107° | 氨 | -77.7 | -33.3 |
| H-O | 467 | 96 | 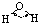 |
104.5° | 水 | 0.0 | 100.0 |
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W的一种核素的质量数为28,中子数为14 |
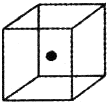
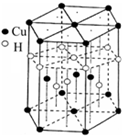 本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应的答题区域内作答.若两题都做,则按A题评分.
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应的答题区域内作答.若两题都做,则按A题评分.| O | 2- 4 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com