
题目列表(包括答案和解析)
(05年天津卷)(14分)磷在氧气中燃烧,可能生成两种固态氧化物。3.1 g的单质磷(P)在3.2 g氧气中燃烧,至反应物耗尽,并放出X kJ热量。
(1)通过计算确定反应产物的组成(用化学式表示)是 ,其相应的质量(g)为 。
(2)已知单质磷的燃烧热为Y kJ/mol,则1mol P与O2反应生成固态P2O3的反应热
ΔH= 。
(3)写出1mol P与O2反应生成固态P2O3的热化学方程式: 。
(05年天津卷)(19分)Ⅰ.某天然油脂A的分子式为C57H106O6。1mol 该油脂水解可得到1mol甘油、1mol不饱和脂肪酸B和2mol直连饱和脂肪酸C。经测定B的相对分子质量为280,原子个数比为C∶H∶O=9∶16∶1。
(1)写出B的分子式: 。
(2)写出C的结构简式: ;C的名称是 。
(3)写出含5个碳原子的C的同系物的同分异构体的结构简式: 。
Ⅱ.RCH=CHR′与碱性KMnO4溶液共热后酸化,发生双键断裂生成羧酸:
RCH=CHR’![]() RCOOH+R’COOH,常利用该反应的产物反推含碳碳双键化合物的结构。在催化剂存在下,1mol不饱和脂肪酸B和1molH2反应后经处理得到D和E的混合物,D和E互为同分异构体。当D和E的混合物与碱性KMnO4溶液共热酸化后,得到如下四种产物:
RCOOH+R’COOH,常利用该反应的产物反推含碳碳双键化合物的结构。在催化剂存在下,1mol不饱和脂肪酸B和1molH2反应后经处理得到D和E的混合物,D和E互为同分异构体。当D和E的混合物与碱性KMnO4溶液共热酸化后,得到如下四种产物:
HCOOC-(CH2)10-COOH CH3-(CH2)7-COOH
HCOOC-(CH2)7-COOH CH3-(CH2)4-COOH
(4)写出D和E的结构简式: 。
(5)写出B的结构简式: 。
(6)写出天然油脂A的一种可能结构简式: 。
(05年天津卷)(19分)根据侯德榜制碱法原理并参考下表的数据,实验室制备纯碱Na2CO3的主要步骤是:将配制好的饱和NaCl溶液倒入烧杯中加热,控制温度在30~35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕后,继续保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质,抽干后,转入蒸发皿中,灼烧2小时,制得Na2CO3固体。
四种盐在不同温度下的溶解度(g/100g水)表
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | -① | - | - | - |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
①>35℃NH4HCO3会有分解
请回答:
(1)反应温度控制在30~35℃,是因为若高于35℃,则 ,若低于30℃,则 ;为控制此温度范围,采取的加热方法为 。
(2)加料完毕后,继续保温30分钟,目的是 。静置后只析出NaHCO3晶体的原因是 。用蒸馏水洗涤NaHCO3晶体的目的是除去 杂质(以化学式表示)。
(3)过滤所得的母液中含有 (以化学式表示),需加入 ,并作进一步处理,使NaCl溶液循环使用,同时可回收NH4Cl。
(4)测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用物质的量浓度为c(mol/L)的HCl溶液滴定至溶液由红色到无色(指示CO32-+H+=HCO3-反应的终点),所用HCl溶液体积为V1 mL,再加1~2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液总体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)=
(05年天津卷)(14分)A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性。下述为相关实验步骤和实验现象:
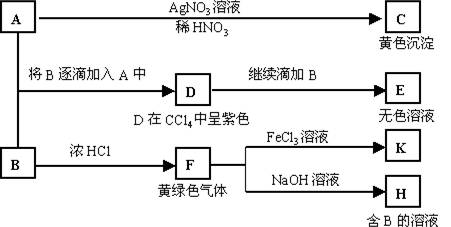
请回答:
(1)写出A、B和C的化学式:A ,B ,C 。
(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:
, 。
(3)写出将SO2气体通入K溶液中发生反应的离子方程式:
(4)写出由F→H的化学方程式: 。
(05年天津卷)在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)=1/2N2(g)+CO2(g);ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是()
A 加催化剂同时升高温度 B 加催化剂同时增大压强
C 升高温度同时充入N2 D 降低温度同时增大压强
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com