能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料.
(1)已知碳的燃烧热△H=-393.5KJ/mol,完全燃烧10mol碳释放的热量为
3935
3935
KJ.
(2)实验测得6.4g 乙醇在氧气中充分燃烧生成CO
2(g)和H
2O(l)时释放出113.5KJ的热量,试写出乙醇燃烧热的热化学方程式:
CH3CH2OH(l)+3O2(g)=2 CO2(g)+3H2O(l)△H=-816.5 kJ/mol
CH3CH2OH(l)+3O2(g)=2 CO2(g)+3H2O(l)△H=-816.5 kJ/mol
(3)从化学键的角度分析,化学反应的实质就是反应物的化学键的断裂和生成物的化学键的形成过程.已知H-H键能为436KJ/mol,H-N键能为391KJ/mol,根据化学方程式:N
2(g)+3H
2(g)?2NH
3(g)△H=-92.4KJ/mol,则 N≡N 键的键能是
945.6
945.6
KJ/mol
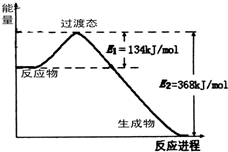
(4)如图是1molNO
2和1molCO反应生成CO
2和NO过程中能量变化示意图,请写出NO
2和CO反应的热化学方程式:
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ/mol
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ/mol
.在反应体系中加入催化剂,E
1的变化是
减小
减小
(填“增大”、“减小”或“不变”),对反应热是否有影响?
无
无
,原因是
反应热的大小只与反应物和生成物所具有的总能量有关
反应热的大小只与反应物和生成物所具有的总能量有关
(5)根据以下3个热化学方程式,判断Q
1、Q
2、Q
3三者大小关系是
Q1<Q2<Q3
Q1<Q2<Q3
2H
2S(g)+3O
2(g)=2SO
2(g)+2H
2O(l)△H=Q
1kJ/mol
2H
2S(g)+O
2(g)=2S (s)+2H
2O(l)△H=Q
2kJ/mol
2H
2S(g)+O
2(g)=2S (s)+2H
2O(g)△H=Q
3kJ/mol.

 直接甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源.
直接甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源. 2NH3,反应1mol N2时放出92.4kJ的热量,则N≡N键键能是( )
2NH3,反应1mol N2时放出92.4kJ的热量,则N≡N键键能是( ) 能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料.
能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料.