
题目列表(包括答案和解析)
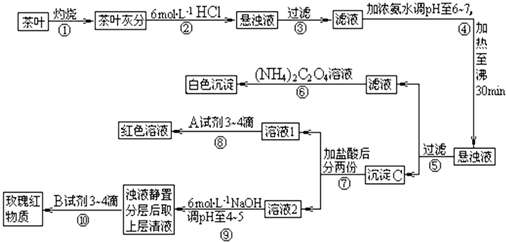
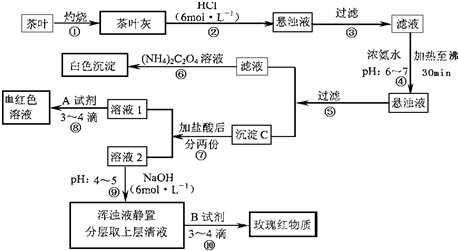
(14分)茶是我国人民喜爱的饮品。某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有Ca、A1、Fe三种元素。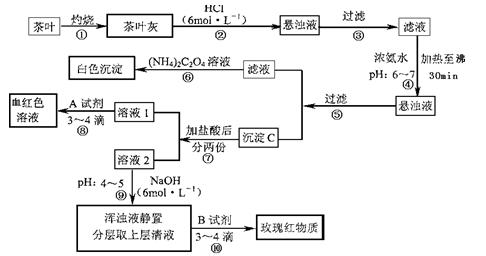
【资料查询】: 草酸铵[(NH4)2C2O4]属于弱电解质。草酸钙(CaC2O4)难溶于水。Ca2+、
草酸铵[(NH4)2C2O4]属于弱电解质。草酸钙(CaC2O4)难溶于水。Ca2+、
A13+、Fe3+完全沉淀的pH:Ca(OH)2:pH≥13;A1(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1。
试根据上述过程及信息填空:
(1)步骤②加盐酸的作用是 。
(2)步骤③操作中用到的玻璃仪器有 。
(3)写出步骤⑥中检验Ca2+存在的离子方程式 。
(4)写出沉淀C所含主要物质的化学式 。
(5)写出步骤⑧中选用A试剂的化学式  。
。
(6)步骤⑨的作用是 ,
猜测步骤⑩的目的是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com