
题目列表(包括答案和解析)
(13分)已知某氯代烃A的相对分子质量为113,且氯的质量分数是62.8%,A进行核磁共振氢谱分析,谱图中只有两组峰。
(1)A的分子式是_________________________
(2)A有如下的转化关系:
①C中的官能团名称是______________;C可以发生的反应有________________。
a.与氢气加成 b.缩聚反应 c.中和反应 d.水解反应 e.取代反应
②D的结构简式为:________________。
(3)巴比妥是一类重要的有机物,其中一些常常可用作镇静和催眠的药物,其结构简式如右图所示,R、R’为烃基或氢原子。
下图是由E合成一种巴比妥H和一种重要有机中间体环戊甲酸(I)的流程:
已知:
①写出E转化为F的化学方程式:_________________________________________。
②巴比妥H的结构简式是_____________________________。
③I有多种同分异构体,其中满足:i属于甲酸酯;ii能使溴的四氯化碳溶液褪色;iii结构中只有一个甲基的共有________种,写出其中任意一种:_________________。
(4)尿素(H2N-CO-NH2)也可与甲醛合成脲甲醛树脂,其可用于耐水性和介电性能要求不高的制品,如插线板、日用品、装饰品,也可用于部分餐具的制造。反应过程如下:
第一步生成聚合前体:
酸性条件:H2N-CO-NH2 + 2HCHO HOCH2NH-CO-NHCH2OH
碱性条件:H2N-CO-NH2 + 4HCHO (HOCH2)2N-CO-N(CH2OH)2
第二步聚合:
第一步反应得到的聚合前体继续在酸性或碱性条件下发生缩聚反应。
①第一步生成聚合前体的反应属于_________反应;要得到体型的脲甲醛树脂,尿素与甲醛需要在_________(填“酸性”或“碱性”)条件下反应。
②写出由酸性条件下得到的聚合前体通过醚键缩聚得到脲甲醛树脂的化学方程式:
____________________________________________________________________________。
A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E,B与G,D与H分别为同一主族,C和D的最外层电子数之和为11,C、D、F三种元素的原子序数之和为28。请回答下列问题:
(1)B与D可形成非极性分子X,过量的X与F D2-溶液反应的离子方程式为____________________________。
(2)E、F、H所形成的简单离子的半径由大到小的顺序为(用离子符号表示) 。
(3)G的最高价氧化物与B的单质在高温下能发生置换反应,其化学反应方程式为:
。
(4)盐Y由B、D、E组成。以熔融盐Y为电解质构成的燃料电池如右图所示。写出石墨(I)电极上发生的电极反应式: 。

(5)用熔融盐Y的燃料电池作电源,以石墨为电极,电解一定浓度的CuSO4溶液至无色后继续电解一段时间。断开电路,向溶液中加入0.1 mol Cu(OH)2,溶液恢复到电解之前的体积和浓度,则电解过程中转移电子的物质的量为______。
(6)由A、C、D、E四种元素中任意三种构成的强电解质Z和W,溶于水时都能促进水的电离,测得Z的水溶液pH>7,W的水溶液pH<7,则Z为 、W为 。
(7)在一个装有可移动活塞的容器中进行如下反应:C2(g)+3A2(g) 2CA3(g),反应达到平衡后,测得容器中含有C2 0.5mol,A20.2mol,CA30.2mol,总容积为1.0L。
2CA3(g),反应达到平衡后,测得容器中含有C2 0.5mol,A20.2mol,CA30.2mol,总容积为1.0L。
①如果达成此平衡前各物质起始的量有以下几种可能,其中不合理的是________:
A.C2 0.6mol, A2 0.5mol, CA30mol
B.C2 0mol, A2 0mol, CA3 1.2mol
C.C2 0.6mol/L,A2 0.5mol/L, CA3 0.1mol/L
②求算此平衡体系的平衡常数K=________;
某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表。
|
实验方案 |
实验现象 |
|
①用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞 |
A.浮于水面,熔成小球,在水面上无定向移动,随之消失,溶液变成红色 |
|
②向新制的H2S饱和溶液中滴加新制的氯水 |
B.产生大量气体,可在空气中燃烧,溶液变成浅红色 |
|
③钠与滴有酚酞试液的冷水反应 |
C.反应不十分剧烈,产生的气体可以在空气中燃烧 |
|
④镁带与2mol·L-1的盐酸反应 |
D.剧烈反应,产生的气体可以在空气中燃烧 |
|
⑤铝条与2mol·L-1的盐酸反应 |
E.生成白色胶状沉淀,继而沉淀消失 |
|
⑥向氯化铝溶液中滴加氢氧化钠溶液 |
F.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:________________________。
(2)实验仪器: _________________________;
(3)实验内容:请将实验方案与实验现象一一对应(*填写题给信息表中的序号),写出化学方程式
|
实验方案* |
实验现象* |
有关化学方程式 |
|
|
|
|
|
|
|
|
(4)实验结论:_______________________________。
(5)请用结构理论简单说明具有上述结论的原因。
(6)请你补充一组事实,说明此周期中另外两种元素的性质递变规律。
A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.回答下列问题:
(1)常温下,X、Y的水溶液的pH均为5.则两种水溶液中由水电离出的H+浓度之比
是 .
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出少量该化合物溶液与
足量的Ba(OH)2溶液反应的离子方程式 .
(3)在一个装有可移动活塞的容器中进行如下反应:C2(g)+3A2(g) 2CA3(g)
2CA3(g)
ΔH=-92.4 kJ·mol-1.反应达到平衡后,测得容器中含有C2 0.5mol,A2 0.2mol,CA3 0.2 mol,总容积为1.0 L.
①如果达成此平衡前各物质起始的量有以下几种可能,其中不合理的是________:
A.C2 0.6mol,A2 0.5mol,CA3 0mol B.C2 0mol,A2 0mol,CA3 1.2mol
C.C2 0.5mol/L,A2 0.3mol/L,CA3 0.2mol/L
②若起始加入1.2molC2、1.0molA2,达平衡后C2的浓度为__________mol/L
③如果保持温度和压强不变,向上述平衡体系中加入0.18molC2,平衡将________(填“正向”、“逆向”或“不”)移动.
(13分)已知某氯代烃A的相对分子质量为113,且氯的质量分数是62.8%,A进行核磁共振氢谱分析,谱图中只有两组峰。
(1)A的分子式是_________________________
(2)A有如下的转化关系:

①C中的官能团名称是______________;C可以发生的反应有________________。
a.与氢气加成 b.缩聚反应 c.中和反应 d.水解反应 e.取代反应
②D的结构简式为:________________。
(3)巴比妥是一类重要的有机物,其中一些常常可用作镇静和催眠的药物,其结构简式如右图所示 ,R、R’为烃基或氢原子。
,R、R’为烃基或氢原子。
下图是由E合成一种巴比妥H和一种重要有机中间体环戊甲酸(I)的流程:

已知:
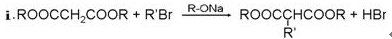

①写出E转化为F的化学方程式:_________________________________________。
②巴比妥H的结构简式是_____________________________。
③I有多种同分异构体,其中满足:i属于甲酸酯;ii能使溴的四氯化碳溶液褪色;iii结构中只有一个甲基的共有________种,写出其中任意一种:_________________。
(4)尿素(H2N-CO-NH2)也可与甲醛合成脲甲醛树脂,其可用于耐水性和介电性能要求不高的制品,如插线板、日用品、装饰品,也可用于部分餐具的制造。反应过程如下:
第一步生成聚合前体:
酸性条件:H2N-CO-NH2 + 2HCHO  HOCH2NH-CO-NHCH2OH
HOCH2NH-CO-NHCH2OH
碱性条件:H2N-CO-NH2 + 4HCHO  (HOCH2)2N-CO-N(CH2OH)2
(HOCH2)2N-CO-N(CH2OH)2
第二步聚合:
第一步反应得到的聚合前体继续在酸性或碱性条件下发生缩聚反应。
①第一步生成聚合前体的反应属于_________反应;要得到体型的脲甲醛树脂,尿素与甲醛需要在_________(填“酸性”或“碱性”)条件下反应。
②写出由酸性条件下得到的聚合前体通过醚键缩聚得到脲甲醛树脂的化学方程式:
____________________________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com