W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素.
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水.向该盐的溶液中滴加足量的盐酸,随着盐酸的逐滴加入,所观察到的现象是
先生成白色沉淀,并逐渐增加到最大量,然后逐渐减少,直至消失
先生成白色沉淀,并逐渐增加到最大量,然后逐渐减少,直至消失
,反应结束时,该反应的总反应离子方程式为
AlO2-+4H+=Al3++2H2O
AlO2-+4H+=Al3++2H2O
.
(2)W与Y可形成化合物W
2Y,该化合物的水溶液显碱性,原因(用离子方程式表示)
S2-+H2O?HS-+H2O;HS-+H2O?H2S+OH-
S2-+H2O?HS-+H2O;HS-+H2O?H2S+OH-
;它的水溶液中存在多种离子,请写出电荷守恒的等式
c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
.
(3)若甲为W的最高价氧化物对应的水化物,乙为Y的氢化物.现有①0.2mol/甲的溶液和②0.2mol/L乙的溶液,则①中由水电离出c(OH
-)
<
<
②中由水电离出的c(OH
-).(填“>”、“=”或“<”)
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为
SO2+Cl2+2H2O=2HCl+H2SO4
SO2+Cl2+2H2O=2HCl+H2SO4
.

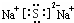
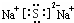
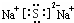
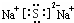
 Al(OH)3+3H+
Al(OH)3+3H+ Al(OH)3+3H+
Al(OH)3+3H+