Ⅰ电离平衡常数(用K表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:
| 化学式 |
HF |
H2CO3 |
HClO |
电离平衡常数
(K) |
7.2×10-4 |
K1=4.4×10-7
K2=4.7×10-11 |
3.0×10-8 |
(1)物质的量浓度均为0.1mol/L的下列四种溶液:①Na
2CO
3溶液 ②NaHCO
3溶液 ③NaF溶液 ④NaClO溶液.依据数据判断pH由大到小的顺序是
.
(2)25℃时,在20mL0.1mol?L
-1氢氟酸中加入VmL0.1mol?L
-1NaOH溶液,测得混合溶液的pH变化曲线如图所示

,下列说法正确的是
.
A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H
+)相等
B.①点时pH=6,此时溶液中,c(F
-)-c(Na
+)=9.9×10
-7mol/L
C.②点时,溶液中的c(F
-)=c(Na
+)
D.③点时V=20mL,此时溶液中c(F
-)<c(Na
+)=0.1mol?L
-1(3)已知25℃时,①HF(aq)+OH
-(aq)=F
-(aq)+H
2O(l)△H=-akJ?mol
-1,
②H
+(aq)+OH
-(aq)=H
2O(l)△H=-bkJ?mol
-1,
氢氟酸的电离方程式及热效应可表示为
.
(4)长期以来,一直认为氟的含氧酸不存在.1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H-O-F.HFO与等物质的量的H
2O反应得到HF和化合物A,则每生成1molHF转移
mol电子.
Ⅱ氯化硫酰(SO
2Cl
2)主要用作氯化剂.它是一种无色液体,熔点-54.1℃,沸点69.1℃.氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:
SO
2(g)+Cl
2(g)

SO
2Cl
2(l)△H=-97.3kJ?mol
-1(1)试写出常温常压下化学平衡常数K的表达式:K=
;
(2)对上述反应,若要使化学平衡常数K增大,化学反应速率v
正也增大,可采取的措施是
(选填编号).
a.降低温度 b.移走SO
2Cl
2c.增加反应物浓度 d.无法满足上述条件
(3)下列描述中能说明上述反应已达平衡的是
(选填编号).
a.υ(Cl
2)=υ(SO
2) b.容器中气体压强不随时间而变化
c.c(Cl
2):c(SO
2)=1:1 d.容器中气体颜色不随时间两变化
(4)300℃时,体积为1L的密闭容器中充入16.20g SO
2Cl
2,达到平衡时容器中含SO
2 7.616g.若在上述中的平衡体系中,再加入16.20g SO
2Cl
2,当再次达平衡时,容器中含SO
2的质量范围是
.

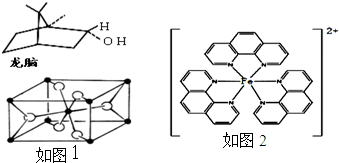 由徐光宪院士发起,院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星.
由徐光宪院士发起,院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星.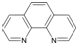 ),它能与Fe2+形成红色混合物(如图2),该配离子中Fe2+与氮原子形成配位键共有
),它能与Fe2+形成红色混合物(如图2),该配离子中Fe2+与氮原子形成配位键共有 ,下列说法正确的是
,下列说法正确的是 SO2Cl2(l)△H=-97.3kJ?mol-1
SO2Cl2(l)△H=-97.3kJ?mol-1