
题目列表(包括答案和解析)
31 |
30 |
| 2 |
| 3 |
元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
Ⅰ.第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。
镓(31Ga)的基态电子排布式是_________________________________________;
31Ga的第一电离能却明显低于30Zn,原因是______________________________________;
Ⅱ.第四周期过渡元素的明显特征是形成多种多样的配合物。
(1)CO和NH3可以和很多过渡金属形成配合物。CO与N2互为等电子体,CO分子中C原子上有一孤电子对,C、O原子都符合8电子稳定结构,则CO的结构式可表示为________________。NH3 分子中N原子的杂化方式为_______杂化,NH3分子的空间立体构型是____________。
(2)向盛有硫酸铜水溶液的试管中加氨水,首先形成蓝色沉淀,继续加入氨水沉淀溶解,得到深蓝色透明溶液,向该溶液中加乙醇,析出深蓝色晶体。蓝色沉淀先溶解,后析出的原因是:__________________________________________(用相关的离子方程式和简单的文字说明加以解释)
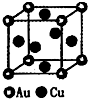
(3)如图甲所示为二维平面晶体示意图,所表示的化学式为AX3的是________。
(4)图乙为一个金属铜的晶胞,此晶胞立方体的边长为acm,Cu的相对原子质量为64,金属铜的密度
为ρ g/cm3,则阿伏加德罗常数可表示为________ mol-1(用含a、ρ的代数式表示)。
根据元素周期表中第四周期元素的相关知识,回答下列问题:
(1)第四周期元素的基态原子的电子排布中4s轨道上只有1个电子的元素有________种;写出Cu+的核外电子排布式________。
(2)按电子排布,可将周期表里的元素划分成五个区域,第四周期元素中属于s区的元素有________种,属于d区的元素有________种。
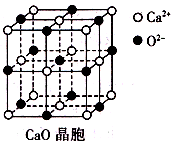
(3)CaO晶胞如右图所示,CaO晶体中Ca2+的配位数为________;CaO的焰色反应为砖红色,许多金属或它们的化合物都可以发生焰色反应,其原因是________________
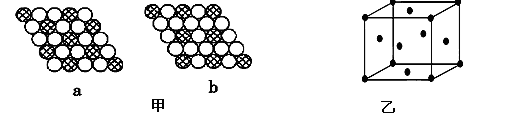
(4)由叠氮化钾(KN3)热分解可得纯N2:2KN3(s)=2K(l)+3N2(g),下列有关说法正确的是________(填选项字母)。
A.NaN3与KN3结构类似,前者晶格能较小
B.晶体钾的晶胞结构如图所示: ,每个晶胞中分摊2个钾原子
,每个晶胞中分摊2个钾原子
C.氮的第一电离能大于氧
D.氮气常温下很稳定,是因为氮的电负性小
(5)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂。O2在其催化作用下,可将CN-氧化成CNO-。CN-的电子式为_______,CNO-的中心原子的杂化方式为_______
(6)在CrCl3溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+ (n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:[CrCln(H2O)6-n]x++xR-H Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1 NaOH溶液25.00 mL,则该配离子的化学式为_______。
Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1 NaOH溶液25.00 mL,则该配离子的化学式为_______。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com