
题目列表(包括答案和解析)
若水中含NaCl的质量分数大于0.3%时,则不能用来浇灌田地.现取某地河水50ml,测得其密度为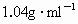 ,恰好和含深质0.34g的
,恰好和含深质0.34g的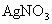 溶液反应完全,生成不溶于
溶液反应完全,生成不溶于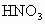 的白色沉淀,通过计算说明此处河水是否可用于浇灌田地.
的白色沉淀,通过计算说明此处河水是否可用于浇灌田地.
氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。请你根据所学知识回答下列问题:
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是_______ ____ 。

(2)为防止氯气尾气污染空气,根据氯水显酸性的性质,可用 溶液吸收多余的氯气,原理是(用离子方程式表示)_______ ___ ______。
(3)据“大河网”报道,2012年3月14日6时40分,位于洛阳市西工区王城大桥北侧建材市场内一个直径约0.5米、高约1米左右的氯气罐发生泄漏。经过安监、环保、公安、消防等部门的通力协作,至9时,氯气泄漏得到有效控制,事件没有造成人员伤亡。当人们逃离爆炸现场时,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是 。
A.NaOH B.NaCl C. KOH D. Na2CO3
(4)实验室制取氯气的反应原理为:MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O ,根据该反应原理回答:
MnCl2 + Cl2↑+ 2H2O ,根据该反应原理回答:
①该反应中被氧化的元素是 ,氧化剂是 。
②浓盐酸表现岀的性质是 性和 性。
③取一定量的浓盐酸使其与二氧化锰反应,产生的氯气在标准状况下的体积为33.6 L,则被氧化的HCl的物质的量为 ,反应中转移电子数为 。
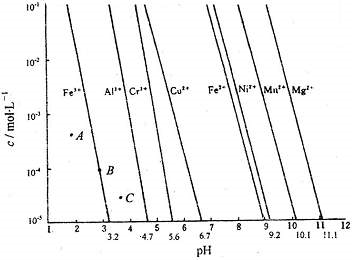
| 难溶电解质 | AgCl | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 1.8×10-10 | 8.3×10-17 | 5.6×10-18 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com