
题目列表(包括答案和解析)
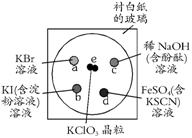
 (8分)为了减少污染,使实验绿色化,学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeSO4(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如右图所示),在圆心处放置2粒芝麻大小的KClO3晶体,盖好表面皿。
(8分)为了减少污染,使实验绿色化,学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeSO4(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如右图所示),在圆心处放置2粒芝麻大小的KClO3晶体,盖好表面皿。
打开表面皿,向KClO3晶体滴加一滴浓盐酸,再立即将表面皿盖好,试描述下列各处反应的现象,并写出相应的离子方程式。
(提示:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O)
a处:
b处:
c处:
d处:
(10分)为了减少污染,使实验绿色化,学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeSO4(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如右图所示),在圆心处放置2粒芝麻大小的KClO3晶体,盖好表面皿。
打开表面皿,向KClO3晶体滴加一滴浓盐酸,再立即将表面皿盖好,试描述反应的现象,并写出相应的化学方程式。
e处:
a处:
b处:
c处:
d处:
为了减少污染,使实验绿色化,学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeSO4(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻大小的KClO3晶体,盖好表面皿.
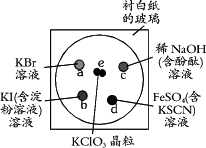
打开表面皿,向KClO3晶体滴加一滴浓盐酸,再立即将表面皿盖好,试描述下列各处反应的现象,并写出相应的离子方程式.
(提示:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O)
a处:________________________
b处:________________________
c处:________________________
d处:________________________
| | 开始沉淀的pH | 沉淀完全的pH | 沉淀溶解的pH |
| Cu2+ | 4.4 | 6.4 | |
| Al3+ | 3.0 | 5.0 | 10 |
| Zn2+ | 5.9 | 8.9 | 11 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com