
题目列表(包括答案和解析)
| 温度 | 10℃ | 40℃ | 55℃ | 70℃ |
| 溶解度 | 20g | 65g | 100g | 140g |
| A、样品为纯净物 |
| B、样品中混有不溶于水的杂质 |
| C、样品中混有溶解度较大的杂质 |
| D、当温度在55℃左右时KNO3完全溶解 |
温度 | 10℃ | 40℃ | 55℃ | 70℃ |
溶解度 | 20g | 65g | 100g | 140g |
下列对该样品的推断中,一定不正确的是( )
A.样品为纯净物
B.样品中混有不溶于水的杂质
C.样品的总质量约为308 g
D.当温度在55℃左右,KNO3全部溶解
有一定质量的KNO3样品,在10 ℃下加蒸馏水使之充分溶解,残留固体的质量为250g。该实验在40 ℃下进行时,残留固体质量为120 g,70 ℃时为20 g。已知KNO3在不同温度下的溶解度:下列对该样品的推断正确的是:
温度 | 10 ℃ | 40 ℃ | 55 ℃ | 70 ℃ |
溶解度 | 20 g | 65 g | 100 g | 140 g |
A.样品为纯净物 B.样品中混有不溶于水的杂质
C.样品中混有溶解度较大的杂质 D.当温度在55℃ 左右时KNO3完全溶解
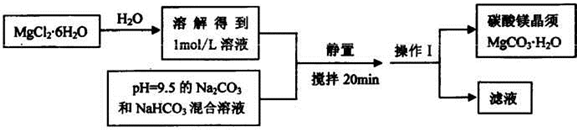
| ||
| ||
| 实验步骤 | 预期的实验现象和结论 |
| 取一定质量的固体样品 置于试管中,滴加足量的稀盐酸 (或置于试管中充分加热,将产生的气体通入到盛有足量澄清石灰水的烧杯) 置于试管中,滴加足量的稀盐酸 (或置于试管中充分加热,将产生的气体通入到盛有足量澄清石灰水的烧杯) |
若 无气泡生成 (或澄清石灰水不变浑浊 ) 无气泡生成 ,则固体产物为Mg(OH)2(或澄清石灰水不变浑浊 ) |
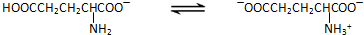
| 5.85(c1V1-c2V2) |
| m |
| 5.85(c1V1-c2V2) |
| m |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com