
题目列表(包括答案和解析)
某消毒液的主要成分为NaCl和NaClO,在空气中易吸收CO2而变质,且NaCl和NaClO在酸性条件下可发生反应:ClO- + Cl- + 2H+ = Cl2↑+ H2O。某学习小组拟探究该消毒液的变质情况。
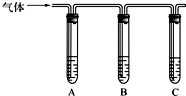
(1)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出。通过下列装置检验气体的成分可以判断消毒液是否变质。
学习小组研究后认为变质情况可能有三种:甲:部分变质;乙:未变质;丙: 。
为了验证可能为甲,请完成下列实验方案。限选试剂:
①98%的浓硫酸 ②1%的品红溶液 ③1.0 mol·L-1 的KI-淀粉溶液 ④1.0 mol·L-1 的NaOH溶液 ⑤澄清石灰水 ⑥饱和NaCl溶液

|
所加试剂 |
预期现象和结论 |
|
试管A中加足量 (填序号); 试管B中加1%品红溶液; 试管C中加 (填序号)。 |
若___ ___, 则甲成立。 |
(2)用滴定法测定消毒液中NaClO的浓度(滴定过程涉及的反应有:NaClO + Na2SO3 = NaCl + Na2SO4 ;2KMnO4 + 5Na2SO3+ 3H2SO4 = K2SO4 + 2MnSO4 + 5Na2SO4 + 3H2O)。实验步骤如下:
①量取25.00 mL消毒液放入锥形瓶中,加入过量的a mol·L-1 Na2SO3溶液v1 mL;
②在使用滴定管之前首先进行的操作是____;将b mol·L-1的酸性KMnO4溶液装入 中;滴定,KMnO4和剩余的Na2SO3发生反应。当溶液由无色变成浅红色,且保持半分钟内红色不褪时,停止滴定,记录数据。
③重复滴定操作2次,平均消耗酸性KMnO4溶液v2 mL。则消毒液中NaClO的浓度为 mol·L-1(用含a、b、v1、v2的代数式表示)。
某消毒液的主要成分为NaCl和NaClO,在空气中易吸收CO2而变质,且NaCl和NaClO在酸性条件下可发生反应:ClO- + Cl- + 2H+ = Cl2↑+ H2O。某学习小组拟探究该消毒液的变质情况。
(1)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出。通过下列装置检验气体的成分可以判断消毒液是否变质。
学习小组研究后认为变质情况可能有三种:甲:部分变质;乙:未变质;丙: 。
为了验证可能为甲,请完成下列实验方案。限选试剂:
①98%的浓硫酸 ②1%的品红溶液 ③1.0 mol·L-1的KI-淀粉溶液 ④1.0 mol·L-1 的NaOH溶液 ⑤澄清石灰水 ⑥饱和NaCl溶液
| 所加试剂 | 预期现象和结论 |
| 试管A中加足量 (填序号); 试管B中加1%品红溶液; 试管C中加 (填序号)。 | 若___ ___, 则甲成立。 |

| 所加试剂 | 预期现象和结论 |
| 试管A中加足量 (填序号); 试管B中加1%品红溶液; 试管C中加 (填序号)。 | 若___ ___, 则甲成立。 |
 (2013?资阳二模)某消毒液的主要成分为NaCl和NaClO,在空气中易吸收CO2而变质,且NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+=Cl2↑+H2O.某学习小组拟探究该消毒液的变质情况.
(2013?资阳二模)某消毒液的主要成分为NaCl和NaClO,在空气中易吸收CO2而变质,且NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+=Cl2↑+H2O.某学习小组拟探究该消毒液的变质情况.| 所加试剂 | 预期现象和结论 |
| 试管A中加足量 ③ ③ (填序号);试管B中加1%品红溶液; 试管C中加 ⑤ ⑤ (填序号). |
若 A中溶液变蓝色,B中溶液不褪色,C中溶液变浑浊 A中溶液变蓝色,B中溶液不褪色,C中溶液变浑浊 ,则甲成立. |
av1-
| ||
| 25 |
av1-
| ||
| 25 |
NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+ = Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况。
(1)此消毒液中NaClO可吸收空气中的CO2生成NaHCO3和HClO而变质。写出化学反应方程式 。
(2)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出。通过以下装置检验气体的成分可以判断消毒液是否变质。
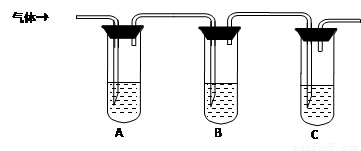
限选试剂:98%浓硫酸、1%品红溶液、1.0 mol·L-1 KI-淀粉溶液、1.0 mol·L-1NaOH、澄清石灰水、饱和NaCl溶液
请完成下列实验方案。
|
所加试剂 |
预期现象和结论 |
|
试管A中加足量① ; 试管B中加1%品红溶液; 试管C中加② 。 |
若A中溶液变蓝色,B中溶液不退色,C中溶液变浑浊。则消毒液部分变质; ③ 则消毒液未变质; ④ 则消毒液完全变质。 |
(3)用滴定法测定消毒液中NaClO的浓度。实验步骤如下:
①量取 25.00mL消毒液放入锥形瓶中,加入过量的a mol·L-1 Na2SO3溶液b mL;
②滴定分析。将c mol·L-1的酸性KMnO4溶液装入 (填酸式或碱式)滴定管中;KMnO4和剩余的Na2SO3发生反应。当溶液由无色变成浅红色,且保持半分钟内红色不退时,停止滴定,记录数据。重复滴定实验2次,平均消耗酸性KMnO4溶液v mL;
滴定过程中涉及的反应有:NaClO + Na2SO3 = NaCl + Na2SO4 ;
2KMnO4 + 5Na2SO3+ 3H2SO4 = K2SO4 + 2MnSO4 + 5Na2SO4 + 3H2O
③计算。消毒液中NaClO的浓度为 mol·L-1(用含a、b、c、v的代数式表示)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com