
题目列表(包括答案和解析)
| |||||||||||||||||||
X、Y、Z、W原子序数依次增大的4种短周期元素,已知:
①X与Z、Y与W分别同族;
②X、Z、W分别与Y都可组成两种中学常见的化合物;
③Y的阴离子与Z的阳离子的核外电子排布相同;
④这4种元素的单质中有一种易溶于CS2溶剂。
(1)写出由Y与Z两元素形成化合物Z2Y2的电子式 。其化学键类型有__________ 。
(2)写出2种均由这4种元素所组成的化合物在水溶液中发生反应的化学方程式______________。
(3)用X、Y两元素的单质可制成已在阿波罗飞船中使用的新型电源,其结构如下图所示。两个电极均由多孔性碳构成,通入的两种单质由孔隙逸出在电极表面放电。
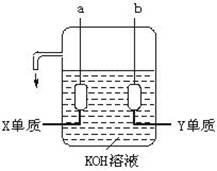 |
①a是电源的_____________极,电极反应式是______________________________;
②b电极上的电极反应式是___________________________。
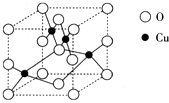 (2009?广东)铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂.
(2009?广东)铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂.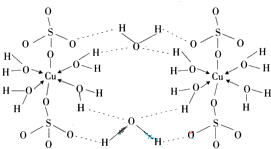
下列说法正确的是( )
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.含有离子键的化合物一定是离子化合物
C.所有金属与所有非金属之间都能形成离子键
D.在化合物Na2O2中,阴、阳离子的个数比为1:1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com