
题目列表(包括答案和解析)
| Li | Be | B | C | O | F |
电负性 | 0.98 | 1.57 | 2.04 | 2.53 | 3.44 | 3.98 |
| Na | Al | Si | P | S | Cl |
电负性 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(1)若Mg、N的电负性分别表示为X?(Mg)、X?(N),则X(Mg)、X(N)的各自范围是:
_________<X(Mg)< _________,_________<X(N)< _________。
(2)电负性与原子半径的关系是____________________________;短周期元素的电负性的变化特点,体现了元素性质的_________变化规律。
(3)某有机物中含有S—N键,你认为共用电子对偏向_________原子。
(4)经验规律告诉我们,当成键的两原子相对应的元素的电负性差值大于1.7时,一般为离子键,当电负性差值小于1.7时,一般为共价键。由此可推测AlBr3中化学键的类型是_________。
A~E是原子序数依次增大的五种短周期元素,其有关性质或结构信息如表所示:
| 元素 | A | B | C | D | E |
| 有关性质或结构信息 | 单质是空气中主要成分之一,其氢化物水溶液呈碱性 | 原子核外有两个未成对电子 | 日常生活中常见的金属,通常用电解法冶炼其单质 | 其简单阴离子带两个单位负电荷 | 单质有毒,常温下为有色气体,常用于自来水消毒 |
请结合表中信息完成下列各小题:
(1)C在元素周期表中的位置是 ,D的简单阴离子的核外电子排布式为 。
(2)如图是A~E的第一电离能和电负性数据,请回答:
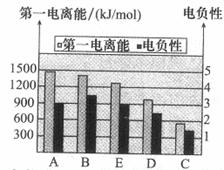
①E的第一电离能大于D,其原理是(根据它们在周期表中的位置解释)
。
②A、B、D三种元素的非金属性由强到弱的顺序是 。
(3)A的常见单质分子有多个共价键。
①常温下,该单质化学性质很稳定,是因为 。
②该单质分子中σ键与π键的数目之比为 。
(4)写出C、E形成的化合物与A的氢化物在水溶液中反应的离子方程式
。
分子(或离子)的空间构型有直线形、角形、平面形、四面体形、三角锥形等。为了解释和预测分子的空间构型,科学家在归纳了已知分子的空间构型的基础上,提出一种简单的理论模型,其理论依据是:分子中的价电子对(包括成键电子对和孤对电子)由于相互排斥作用,而取向彼此远离以减小斥力,分子尽可能采取对称的空间构型。对于ABm形分子(A为中心原子,B为配位原子),分子中的价电子对数(n)可以通过下式确定:
![]()
| 分子构型 | AB2 | AB3 | AB2 | AB3 | AB4 |
| 价电子对数 | 2 | 3 | 4 | 4 | 4 |
| 几何构型 | 直线形 | 平面形 | 角形 | 三角锥形 | 四面体形 |
说明:①作为配位原子,氧原子、硫原子按不提供价电子计算;
②直线形分子中最少有3个原子,平面形分子中最少有4个原子。
(1)指出下面物质分子或离子的空间构型:PO43- ;CS2 ;AlBr3(共价分子) 。
(2)有两种活性反应中间体微粒,它们的微粒中均含有1个碳原子和3个氢原子。请依据下面给出的这两种微粒的球棍模型,写出相应的化学式:

(3)按要求写出第二周期非金属元素构成的中性分子的化学式:
平面形分子 ,三角锥形分子 ,四面体形分子 。
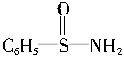 ,其中S―N中,你认为共用电子对偏向谁?__________(写原子名称)。
,其中S―N中,你认为共用电子对偏向谁?__________(写原子名称)。【物质结构与性质】(8分)
组成蛋白质的元素主要有C、H、O、N及S、P和少量的Cu、Fe、Zn等,其中铜及其合金是人类最早使用的金属材料,用途广泛。
(1)铜原子的核外电子排布式是 ;O、N、S的第一电离能由大到小的顺序为 。
(2)铜的熔点比钙高,其原因是 ;
右图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为 。
(3)Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[Cu(NH3)4]2+中存在的化学键类型有 (填序号)。
A.配位键B.金属键C.极性共价键D.非极性共价键E.离子键
②[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为 (填序号)。
A.平面正方形 B.正四面体 C.三角锥型 D.V型
③某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:
HOCH2CH=CH2→CH3CH2CHO。在丙烯醇分子中发生某种方式杂化的碳原子数是丙醛分子中发生同样方式杂化的碳原子数的2倍,则这类碳原子的杂化方式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com