
题目列表(包括答案和解析)
| W | X | Y |
| Z |
| A、四种元素的原子半径:rZ>rX>rY>rW |
| B、四种元素形成的单质最多有6种 |
| C、四种元素均可与氢元素形成电子总数为18的分子 |
| D、四种元素中,Z的最高价氧化物对应的水化物酸性最强 |
下表为元素周期表的一部分。请回答下列问题:
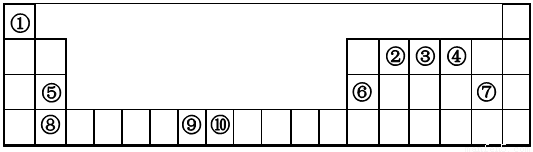
根据元素在周期表中的相对位置可知①~⑩分别是H、C、N、O、Mg、Al、Cl、Ca、Mn、Fe。
(1)上述元素中,属于s区的是____________(填元素符号)。
(2)写出元素④的基态原子的价电子排布图____________________。
(3)元素第一电离能为⑨________⑩ (填“大于”或“小于”)。
(4)元素③气态氢化物的VSEPR模型为________;该分子为________分子(填“极性”或“非极性”)。向硫酸铜溶液中逐滴加入其水溶液,可观察到的现象为_____________________________。
(5)⑥单质的晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
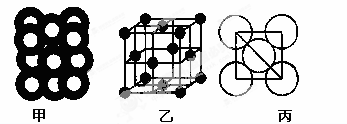
若已知⑥的原子半径为dcm,NA代表阿伏加德罗常数,元素⑥的相对原子质量为M,请回答:晶胞中⑥原子的配位数为 ,该晶体的密度为 (用字母表示)
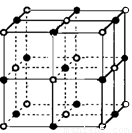
(6)实验证明:⑤和⑧的氧化物、KCl、TiN这4种晶体的结构与NaCl晶体结构相似(如下图所示),已知3种离子晶体的晶格能数据如下表:
|
离子晶体 |
NaCl |
KCl |
CaO |
|
晶格能/kJ·mol-1 |
786 |
715 |
3401 |
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是: (用化学式填写)。
其中⑧的氧化物晶体中一个阳离子周围和它最邻近且等距离的阳离子有 个。
(15分)六种短周期元素在周期表中的相对位置如下所示,其中E元素原子核外电子总数是其最外层电子数的3倍。关于元素周期表及这六种元素性质,请回答:
| A | B | C |
| D | E | F |
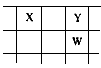
核电荷数由小到大顺序排列的五种短周期元素X、Y、Z、W、Q.其中:在同周期元素中,Z的金属性最强,Q的非金属性最强;W的单质是淡黄色固体;X、Y、W在周期表中的相对位置关系如图所示:

(1)五种元素形成的单质,其中:固态时属于原子晶体的是________(填化学式);常用做强氧化剂的是________、________(填化学式).
(2)这五种元素中,原子半径最大的是________(填化学式);由Z、W、Q形成简单离子半径由大到小的顺序是________(用化学式表示);X、W、Q的最高价氧化物的水化物酸性从强到弱的顺序为________(用化学式表示).
(3)Y和Z形成的一种化合物中含有离子键和共价键,写出该化合物与水反应的化学方程式________.
(4)Z与Q反应生成的化合物属于________化合物;电解该化合物的饱和溶液阳极的电极反应式为________;电解一段时间后,将阳极产物和阴极溶液混合反应的化学方程式是________.
(5)由X、Y和氢三种元素组成的化合物X6H12Y6,已知:9 g该化合物燃烧生成XY2和液态H2Y时,放出140 kJ的热.写出该化合物燃烧热的热化学方程式:________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com