运用化学反应原理研究氮、碳、硫等单质及其化合物的反应有重要意义。
(1)氨在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2mol NH
3,放出92.2kJ热量。
①若起始时向容器内放入2mol N
2和6mol H
2,达平衡后放出的热量为Q,则Q(填 “>”、“<”或“=”)
184.4 kJ。
②已知

1mol N—H键断裂吸收的能量等于
kJ。
(2)硫酸的年产量可以用来衡量一个国家的化工生产能力。工业生产硫酸的流程中存在反应:2SO
2(g)+O
2(g)
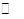
2SO
3(g)。反应体系中SO
3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
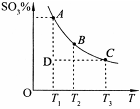
①该反应的

0(填“>’或“<”)。
②下列说法正确的是
a.若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡不移动
b.在D点时,v
正>v
逆c.B点、C点反应的平衡常数分别为K
1、K
2,则K
1<K
2d.在A点时,消耗1mol SO
2必定同时消耗1mol SO
3(3)过度排放CO
2会造成温室效应。
①最近科学家提出“绿色自由”构想能把空气中的CO
2转变为可再生燃料甲醇。甲醇可制作燃料电池,写出该电池负极反应式(电解液为KOH溶液)
。
②CO
2也可用NaOH溶液吸收得到Na
2CO
3溶液,写出该反应的离子方程式
。
Na
2CO
3水溶液呈碱性,其原因是
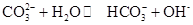
,25℃时该反应的K=2×10
-4mol·L
-1,则当溶液中c(HCO- 3):c(CO2- 3)=2∶1时,溶液的pH=
。


 2SO3(g)。反应体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g)。反应体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
 0(填“>’或“<”)。
0(填“>’或“<”)。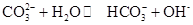 ,25℃时该反应的K=2×10-4mol·L-1,则当溶液中c(HCO- 3):c(CO2- 3)=2∶1时,溶液的pH= 。
,25℃时该反应的K=2×10-4mol·L-1,则当溶液中c(HCO- 3):c(CO2- 3)=2∶1时,溶液的pH= 。