
题目列表(包括答案和解析)
| ||
| ||
| ||
| ||
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题。
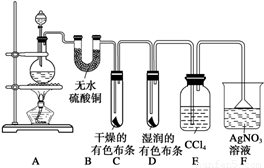
(1)下列方法中,可制得氯气的正确组合是 。
①MnO2和浓盐酸混合共热
②KMnO4和浓盐酸混合 ③氯酸钠和浓盐酸混合 ④K2Cr2O7和浓盐酸混合
A.①②③ B.①②④ C.①② D.全部可以
(2)若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制取Cl2,制得的Cl2体积(标准状况下)总是小于1.12 L的原因是 。
(3)①装置B的作用是 ,现象是 。
②装置C和D出现的不同现象说明的问题是 。
③装置E的作用是
目前我国饮用水消毒主要用氯——通氯气,加漂白粉或漂白精。
(1) 漂白粉或漂白精长期放置于空气中会变质失效,其化学方程式是__________________。
(2)目前我国广泛采用经过干燥空气稀释的氯气,通入填有固体亚氯酸钠(NaClO2)的柱内
制得ClO2,这一反应的化学方程式是:_________________________________________。
 2Na+Cl2↑
2Na+Cl2↑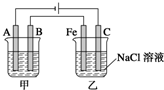 如图所示:甲、乙为相互串联的两电解池.试回答:
如图所示:甲、乙为相互串联的两电解池.试回答:湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com