
题目列表(包括答案和解析)
A、B、C、D、E五种物质能按图示变化(反应条件略):
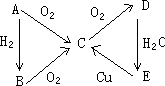
①若A在通常状况下是固体,则A、B、C、D、E的化学式分别为:A________,B________,C________,D________,E________.
②若A在通常状况下是气体,则A、B、C、D、E的化学式分别是:A________,B________,C________,D________,E________.
请根据实验现象,按要求回答问题:
(1)将铁粉加入到C的溶液中,振荡过滤后,溶液的质量增加,颜色也有明显的变化。则可确认C中含有___________离子。发生反应的离子方程式为__________________________。
(2)用pH试纸测定,只有A、E两溶液呈碱性,且pH均为11。则A、E的化学式可能是_____________、_____________。为进一步确认A和E,现提供蒸馏水、pH试纸、量筒等实验用品,请你设计简单的实验方案:_______________________________________。
(3)将BaCl2溶液分别加入B和D的溶液中,只有D溶液中产生白色沉淀,且不溶于稀硝酸。则B、C、D的化学式分别是B_____________,C_____________,D_____________。
(1)元素C在周期表中的位置是________________;
(2)化合物M中含有的化学键类型有__________;
(3)写出化合物Y与Z之间反应的离子方程式:_______________________________;
(4)以铂作电极,以Y溶液作为电解质溶液,A、C元素的单质分别在两电极上发生原电池反应,则正极上的电极反应式为________________;若以该电池作为电源,用惰性电极电解
A 、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐M;D与A同主族,且与E同周期;E元素原子的最外层电子数比次外层电子数少2;A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物。请回答:
(1)C和E两种元素相比较,非金属性较强的元素在周期表中的位置为 ,以下三种说法中,可以验证C和E非金属性强弱的是 。
a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,C元素显负价
c.比较这两种元素的气态氢化物的稳定性
(2)用元素符号表示B,C,D三种元素的第一电离能由大到小的顺序为 。
(3)盐M中含有的化学键类型有
,B的最高价含氧酸N,常温下,若M,N两种溶液的pH均等于5,则由水电离出的
(4)D元素的最高价氧化物对应水化物能与地壳中含量最多的金属元素形成的单质反应,试写出该反应的离子方程式 ,用离子方程式表示该反应生成的盐溶液显碱性的原因
(5)C和D按原子个数比1:1形成一种离子化合物R,已知常温时R与水反应,恢复至原状态测得:每转移1 mol电子放出QkJ的热量,试写出R与水反应的热化学反应方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com