某芳香族化合物A式量小于150,氢氧质量比为1:8,完全燃烧后只生成CO
2和H
2O.取等质量的A分别与足量NaHCO
3和Na反应,生成的气体在同温同压下的体积比为1:1.工业常用A来合成药物B及医药中间体G,流程如下:

已知:


(1)写出A含有的官能团的名称
羟基、羧基
羟基、羧基
,D的结构简式
.
(2)D生成E的反应类型是
酯化反应
酯化反应
.
(3)A合成B的同时,A自身之间也能发生缩聚反应,写出该缩聚反应的化学方程式
n


+(n-1)H
2O
n


+(n-1)H
2O
.
(4)写出F与过量NaOH共热时反应的化学方程式
.
(5)B有多种同分异构体,写出符合下列条件的一种物质的结构简式

或
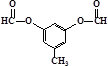

或

.
①只有一种官能团 ②能发生银镜反应
③苯环上的一氯取代物只有二种 ④核磁共振谱共有四组峰,个数比为3:2:2:1.
(6)下列有关说法正确的是
BC
BC
.
A.可由A经一步反应获得D
B、

与G互为同分异构体
C.G易水解,可用FeCl
3溶液检验是否发生水解
D.1molG一定能和5mol氢气反应.







 +(n-1)H2O
+(n-1)H2O
 +(n-1)H2O
+(n-1)H2O

 或
或
 或
或
 与G互为同分异构体
与G互为同分异构体