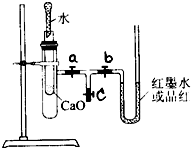
某校化学兴趣小组的同学按图所示将实验装置连接好,进行化学能与热能转化的实验探究.请帮他们回答下列问题:
实验前,在U型管内加入少量品红溶液(或红墨水).打开3个T型管螺旋夹,使U型管内两边的液面处于同一水平面,再夹紧螺旋夹.
(1)在内部的试管里盛1g氧化钙,当滴入2mL左右的蒸馏水后,打开a、b螺旋夹,可观察到U型管里的红墨水如何变化?
U型管里的红墨水向右移动,导致右侧液面高于左侧液面
U型管里的红墨水向右移动,导致右侧液面高于左侧液面
.
(2)如果用这个装置观察到U型管内出现与上述(1)相反的现象,可在小试管中加入
NH4Cl或NH4NO3等铵盐
NH4Cl或NH4NO3等铵盐
固体后滴入适量的蒸馏水.
(3)若向内部的试管中放入几小块铜片,再用滴管滴入10mL稀硝酸,能否得到(1)中现象?
能
能
,另外可观察到的现象是
铜片表面有气泡冒出,过一会儿,试管口附近有红棕色气体出现,U型管里的红墨水向右移动
铜片表面有气泡冒出,过一会儿,试管口附近有红棕色气体出现,U型管里的红墨水向右移动
;产生上述现象的原因是
铜片和稀硝酸反应生成NO,NO被氧气氧化为NO2;该反应放热,使大试管内气压增大,导致U型管里的红墨水向右移动
铜片和稀硝酸反应生成NO,NO被氧气氧化为NO2;该反应放热,使大试管内气压增大,导致U型管里的红墨水向右移动
;写出有关反应的化学方程式
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,2NO+O2=2NO2
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,2NO+O2=2NO2
;由此可知,反应后产物的总能量
小于
小于
(填“大于”、“小于”、“等于”)硝酸和铜片的总能量.此时该装置有明显的不足,原因是
NO、NO2逸散到空气中,会造成环境污染
NO、NO2逸散到空气中,会造成环境污染
,改进的方法是
在试管上加一双孔塞,用导气管将生成的气体导入到氢氧化钠溶液中
在试管上加一双孔塞,用导气管将生成的气体导入到氢氧化钠溶液中
.

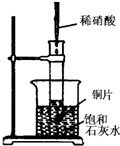 如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块铜片,再用滴管滴入10mL稀硝酸.据此回答下列问题:
如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块铜片,再用滴管滴入10mL稀硝酸.据此回答下列问题: (1)如图所示是实验室中制取气体的一种简易装置.①甲同学用下列方法检验装置的气密性,请问能否达到目的
(1)如图所示是实验室中制取气体的一种简易装置.①甲同学用下列方法检验装置的气密性,请问能否达到目的 某校化学兴趣小组的同学按图所示将实验装置连接好,进行化学能与热能转化的实验探究.请帮他们回答下列问题:
某校化学兴趣小组的同学按图所示将实验装置连接好,进行化学能与热能转化的实验探究.请帮他们回答下列问题:![]() 2HI+H2SO4
2HI+H2SO4![]() 2FeCl2+2HCl+I2
2FeCl2+2HCl+I2![]() 2FeCl3+NO↑+2H2O+Fe(NO3)3
2FeCl3+NO↑+2H2O+Fe(NO3)3