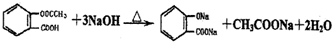
阿司匹林被誉为“百年新药”,阿司匹林药片的有效成分是乙酰立杨酸,它是一种白色晶体,微溶于水.其结构简式为:

(相对分子质量为180).
已知:阿司匹林药片中一般添加少量的辅料(都不溶于水,也不与NaOH反应);某课外学习小组为检验阿司匹林有效成分中的官能团并测定乙酰水杨酸在药片中的含量,进行了如下实验:
(1)用氢氧化钠固体配制250mL 0.10mol/L氢氧化钠溶液,完成有关填空.
a.计算所需氢氧化钠的质量;
b.向烧杯中加入适量水,搅拌、使其溶解;
c.用水洗涤烧杯、玻璃棒,洗液注入容量瓶;
d.在托盘天平上通过烧杯称量
1.0
1.0
g氢氧化钠固体;
e.盖好瓶塞,上下颠倒、摇匀;
f.冷却,将溶液移入250mL容量瓶中;
g.加水至距刻度线1-2cm处改用胶头滴管定容;
h.装瓶、贴上标签、备用
用字母表示正确的配制步骤(只填字母):
a-d-b-f-c-g-e-h
a-d-b-f-c-g-e-h
;
(2)配制250mL 0.10mol/L盐酸溶液;
(3)取阿司匹林药片于
研钵
研钵
中研碎,再称量0.3克放入锥形瓶中;滴定次数0.1mol/L盐酸读数/mL滴定前滴定后10.0017.9821.5616.5830.2215.20
(4)用碱式滴定管取25.00mL 0.10mol/L氢氧化钠溶液(过量)注入上述锥形瓶中并加热、搅拌充分反应.写出反应化学方程式:
;
(5)冷却后,在锥形瓶中加入2-3滴酚酞,用0.10mol/L盐酸滴定未反应的氢氧化钠,左手控制活塞,右手轻摇锥形瓶,眼睛
要注视锥形瓶内溶液的颜色变化
要注视锥形瓶内溶液的颜色变化
,直到溶液变为无色,在半分钟内不复原为止,记录读数.某学生取等质量阿司匹林完成实验,滴定前后的有关读数记录如图表:用有关数据计算该药片中乙酰水杨酸的质量分数为
20%
20%
;
| 滴定次数 |
0.1mol/L盐酸读数/mL |
| 滴定前 |
滴定后 |
| 1 |
0.00 |
17.98 |
| 2 |
1.56 |
16.58 |
| 3 |
0.22 |
15.20 |
(6)不能将阿司匹林溶解于水后直接用NaOH溶液进行滴定的原因是
乙酸水杨酸微溶,与NaOH反应缓慢,导致不能完全反应
乙酸水杨酸微溶,与NaOH反应缓慢,导致不能完全反应
.
(7)下列操作可能使测定结果(质量分数)偏高的是
A
A
.
A.配制盐酸溶液时俯视刻度线定容
B.锥形瓶瓶壁残留蒸馏水
C.滴定前酸式滴定管尖嘴处有气泡,滴定后气泡消失
D.量取氢氧化钠溶液体积时开始时仰视刻度线,结束时俯视刻度线.

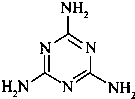 三聚氰胺(结构简式如右)由于含氮量高而常被不法商人用作食品添加剂,因此三聚氰胺也被人称为“蛋白精”. 三聚氰胺是一种纯白色晶体,无味,常压熔点354℃(分解);快速加热升华,升华温度300℃.三聚氰胺早期合成使用双氰胺法:由电石(CaC2)在N2氛围中加热可制备氰胺化钙(CaCN2),氰胺化钙水解后二聚生成双氰胺(C2H4N4),再加热即转化为三聚氰胺.与该法相比,尿素法成本低,目前较多采用.尿素以氨气为载体,硅胶为催化剂,在380-400℃温度下沸腾反应生成三聚氰胺:6CO(NH2)2→C3N6H6+6NH3+3CO2.
三聚氰胺(结构简式如右)由于含氮量高而常被不法商人用作食品添加剂,因此三聚氰胺也被人称为“蛋白精”. 三聚氰胺是一种纯白色晶体,无味,常压熔点354℃(分解);快速加热升华,升华温度300℃.三聚氰胺早期合成使用双氰胺法:由电石(CaC2)在N2氛围中加热可制备氰胺化钙(CaCN2),氰胺化钙水解后二聚生成双氰胺(C2H4N4),再加热即转化为三聚氰胺.与该法相比,尿素法成本低,目前较多采用.尿素以氨气为载体,硅胶为催化剂,在380-400℃温度下沸腾反应生成三聚氰胺:6CO(NH2)2→C3N6H6+6NH3+3CO2. (相对分子质量为180).
(相对分子质量为180).