
题目列表(包括答案和解析)
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
(1)如图为C及其氧化物的变化关系图,若①变化是置换反应,则其化学方程式可为______________________________________;
图中变化过程哪些是吸热反应________(填序号)。
(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用如下方法合成甲醇:
方法一 CO(g)+2H2(g)??CH3OH(g)
方法二 CO2(g)+3H2(g)??CH3OH(g)+H2O(g)
在25℃、101 kPa下,1克甲醇完全燃烧放热22.68 kJ,写出甲醇燃烧的热化学方程式:_____________________________________________;
某火力发电厂CO2的年度排放量是2 200万吨,若将此CO2完全转化为甲醇,则理论上由此获得的甲醇完全燃烧放热约是________kJ(保留三位有效数字)。
(3)金属钛冶炼过程中其中一步反应是将原料金红石转化:TiO2(金红石)+2C+2Cl2高温,TiCl4+2CO 已知:C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1
TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=________。
(4)臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)=3Ag2O(s) ΔH=-235.8 kJ·mol-1,
已知:2Ag2O(s)=4Ag(s)+O2(g)ΔH=+62.2 kJ·mol-1,
则O3转化为O2的热化学方程式为_________________________。
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
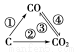
(1)如图为C及其氧化物的变化关系图,若①变化是置换反应,则其化学方程式可为______________________________________;
图中变化过程哪些是吸热反应________(填序号)。
(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用如下方法合成甲醇:
方法一 CO(g)+2H2(g)??CH3OH(g)
方法二 CO2(g)+3H2(g)??CH3OH(g)+H2O(g)
在25℃、101 kPa下,1克甲醇完全燃烧放热22.68 kJ,写出甲醇燃烧的热化学方程式:_____________________________________________;
某火力发电厂CO2的年度排放量是2 200万吨,若将此CO2完全转化为甲醇,则理论上由此获得的甲醇完全燃烧放热约是________kJ(保留三位有效数字)。
(3)金属钛冶炼过程中其中一步反应是将原料金红石转化:TiO2(金红石)+2C+2Cl2高温,TiCl4+2CO 已知:C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1
TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=________。
(4)臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)=3Ag2O(s) ΔH=-235.8 kJ·mol-1,
已知:2Ag2O(s)=4Ag(s)+O2(g)ΔH=+62.2 kJ·mol-1,
则O3转化为O2的热化学方程式为_________________________。

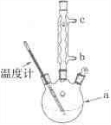
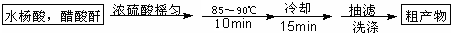

| 名 称 | 相对分子质量 | 熔点或沸点(0C) | 水 | 醇 | 醚 |
| 水杨酸 | 138 | 158(熔点) | 微溶 | 易溶 | 易溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 反应 | 可溶 | 易溶 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 | 可溶 | 微溶 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com