
题目列表(包括答案和解析)
(13分)
(1) 用NH3做主要原料按下列流程生产化肥NH4NO3。其中a%、b%、c%分别表示对应反应的转化率,NH3与HNO3反应生成NH4NO3原料利用率为100%
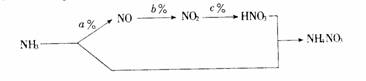
若用1tNH3为原料,为了使制得的NH4NO3产量最大,则用于制HNO3的NH3质量为 t(用含a、b、c的代数式表示)
(2) 铵态氮肥在碱性条件下使用会导致肥效损失,NH4H2PO4溶液与足量NaOH溶液共热反应的离子方程式为 。
(3) 一种复合肥料含有NH4NO3 、NH4H2PO4、KCl,取其一定量溶于水形成溶液,测得其中部分离子浓度为:c(NH4+)=3mol•l-1,c(H2PO4-)=2mol•l-1,c(K+)=2mol•l-1,则配制该复合肥料所取的NH4NO3 、NH4H2PO4、KCl的物质的量之比为 。
(4) 人们一直致力于人工固氮的研究以获得廉价的氮肥。科学家先后提出并合成固氮酶的多种模拟物。其中一类是含Mo、Fe、S原子的“类立方体”结构,如图所示:
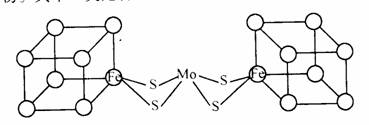
图中左、右两边对称,各含一个近似为立方体的结构。每个立方体含有4个Fe原子、4个S原子,它们位于立方体的8个顶点,且原子间只有一种化学键。
①请在图中左边立方体的○中填写出其余3个Fe原子。
②上述一个立方体中4个Fe原子所在的顶点连接所构成的空间几何体为 。
以白云石(化学式表示为MgCO3·CaCO3)为原料制备Mg(OH)2的工艺流程如下图所示。
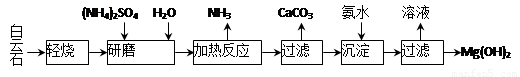
(1)研磨的作用是 。
(2)该工艺中可循环使用的物质是 、 (写化学式)。
(3)白云石轻烧的主要产物是MgO·CaCO3,而传统工艺是将白云石加热分解为MgO和CaO后提取,白云石轻烧的优点是 。
(4)加热反应的离子方程式为 。
(5)①加热反应时,在323k和353k溶液中c(NH4+)与反应时间的关系如下图所示,请在下图画出373k的曲线。
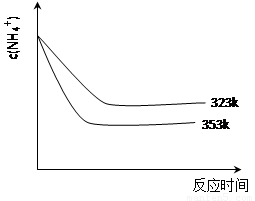
②由图可知,随着温度升高: 。
以白云石(化学式表示为MgCO3·CaCO3)为原料制备Mg(OH)2的工艺流程如下图所示。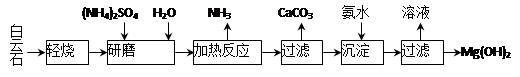
(1)研磨的作用是 。
(2)该工艺中可循环使用的物质是 、 (写化学式)。
(3)白云石轻烧的主要产物是MgO·CaCO3,而传统工艺是将白云石加热分解为MgO和CaO后提取,白云石轻烧的优点是 。
(4)加热反应的离子方程式为 。
(5)①加热反应时,在323k和353k溶液中c(NH4+)与反应时间的关系如下图所示,请在下图画出373k的曲线。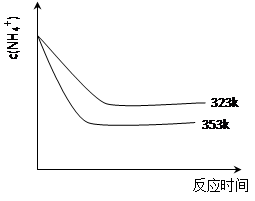
②由图可知,随着温度升高: 。
以白云石(化学式表示为MgCO3·CaCO3)为原料制备Mg(OH)2的工艺流程如下图所示。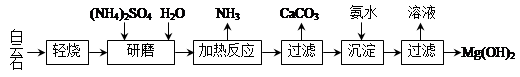
(1)研磨的作用是 。
(2)该工艺中可循环使用的物质是 、 (写化学式)。
(3)白云石轻烧的主要产物是MgO·CaCO3,而传统工艺是将白云石加热分解为MgO和CaO后提取,白云石轻烧的优点是 。
(4)加热反应的离子方程式为 。
(5)①加热反应时,在323k和353k溶液中c(NH4+)与反应时间的关系如下图所示,请在下图画出373k的曲线。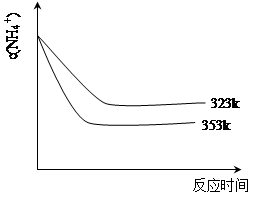
②由图可知,随着温度升高: 。
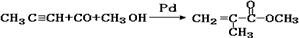
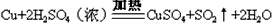
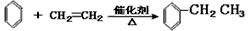 (催化剂是氯化铝,氯化铝和加入的盐酸都有较强的腐蚀性,生产过程中产生大量废液、废气)
(催化剂是氯化铝,氯化铝和加入的盐酸都有较强的腐蚀性,生产过程中产生大量废液、废气)  2CuO CuO+2HNO3(稀)=Cu(NO3)2+H2O
2CuO CuO+2HNO3(稀)=Cu(NO3)2+H2O 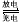 2Ni(OH)2+Cd(OH)2 已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸。在酸性土壤中这种污染尤为严重。这是因为_______________________。
2Ni(OH)2+Cd(OH)2 已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸。在酸性土壤中这种污染尤为严重。这是因为_______________________。 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com