
题目列表(包括答案和解析)
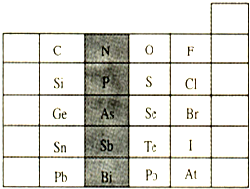 元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分.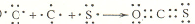
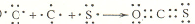


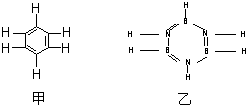 (2012?洛阳二模)已知化合物C6H6(苯)与B3N3H6(硼氮苯)的分子结构相似,如图则硼氮苯的二氯取代物B3N3H4Cl2的同分异构体的数目为( )
(2012?洛阳二模)已知化合物C6H6(苯)与B3N3H6(硼氮苯)的分子结构相似,如图则硼氮苯的二氯取代物B3N3H4Cl2的同分异构体的数目为( ) ,已知断裂1molB-B吸收167kJ的热量,生成1molB≡B放出942kJ热量.试写出由B4气态分子变成B2气态分子的热化学方程式:
,已知断裂1molB-B吸收167kJ的热量,生成1molB≡B放出942kJ热量.试写出由B4气态分子变成B2气态分子的热化学方程式:

| A、同系物的化学性质相似 | B、同位素的化学性质几乎相同 | C、分子量相同的几种化合物互称为同分异构体 | D、同素异形体之间、同分异构体之间的转化属于化学变化 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com