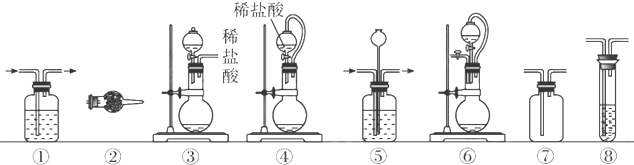
实验室制备1,2-二溴乙烷的反应原理如下:
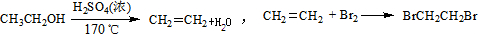
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.
用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
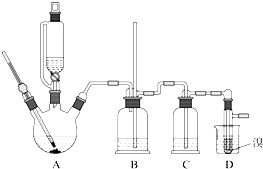
有关数据列表如下:
|
乙醇 |
1,2-二溴乙烷 |
乙醚 |
| 状态 |
无色液体 |
无色液体 |
无色液体 |
| 密度/g?cm-3 |
0.79 |
2.2 |
0.71 |
| 沸点/℃ |
78.5 |
132 |
34.6 |
| 熔点/℃ |
-130 |
9 |
-116 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是
d
d
;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入
c
c
,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是
溴的颜色完全褪去
溴的颜色完全褪去
;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在
下
下
层(填“上”、“下”);
(5)若产物中有少量未反应的Br
2,最好用
b
b
洗涤除去;(填正确选项前的字母)
a.水b.氢氧化钠溶液c.碘化钠溶液d.乙醇
(6)若产物中有少量副产物乙醚,可用
蒸馏
蒸馏
的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是
乙烯与溴反应时放热,冷却可避免溴的大量挥发
乙烯与溴反应时放热,冷却可避免溴的大量挥发
;但又不能过度冷却(如用冰水),其原因是
1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞
1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞
.


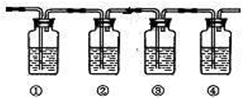 实验室制乙烯通常采用乙醇与浓硫酸(体积比为1:3)混合加热到170℃制得,反应过程中乙醇常被炭化,溶液中有黑色物质出现,随着反应进行炭化现象越来越严重,同时制得的乙烯气体中通常会含有CO2、SO2等气体,为确认混合气体中含有乙烯和二氧化硫,可让混合气体依次通过如图实验装置.(可供选择的试剂:品红溶液、氢氧化钠溶液、溴水、酸性高锰酸钾溶液、浓硫酸,试剂可重复使用.)
实验室制乙烯通常采用乙醇与浓硫酸(体积比为1:3)混合加热到170℃制得,反应过程中乙醇常被炭化,溶液中有黑色物质出现,随着反应进行炭化现象越来越严重,同时制得的乙烯气体中通常会含有CO2、SO2等气体,为确认混合气体中含有乙烯和二氧化硫,可让混合气体依次通过如图实验装置.(可供选择的试剂:品红溶液、氢氧化钠溶液、溴水、酸性高锰酸钾溶液、浓硫酸,试剂可重复使用.)