
题目列表(包括答案和解析)

 H++HA- HA-
H++HA- HA- H++A2-
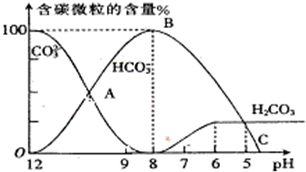
H++A2- I.常温下在20mL0.1mol?L-1Na2CO3溶液中逐滴加入0.1mol?L-1 HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.回答下列问题:
I.常温下在20mL0.1mol?L-1Na2CO3溶液中逐滴加入0.1mol?L-1 HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.回答下列问题: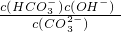 =2×10-4,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=______.
=2×10-4,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=______. H++HA- HA-
H++HA- HA- H++A2-
H++A2-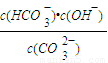 =2×10-4,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=______.
=2×10-4,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=______. H++HA- HA-
H++HA- HA- H++A2-
H++A2-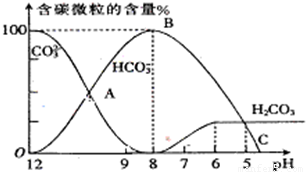
 I.常温下在20mL0.1mol?L-1Na2CO3溶液中逐滴加入0.1mol?L-1 HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.回答下列问题:
I.常温下在20mL0.1mol?L-1Na2CO3溶液中逐滴加入0.1mol?L-1 HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.回答下列问题:c(
| ||
c(
|
 H++HA- HA-
H++HA- HA- H++A2-
H++A2-湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com