
题目列表(包括答案和解析)
| ||
| ||
某有机物A的分子式为C6H8O7,对其进行如下实验。
①将 1.92 g A与100 mL 0.3 mol/L碳酸氢钠溶液混合,恰好反应。
②在一定条件下,能与乙酸发生酯化反应。
请根据题目要求回答问题。
(1)推测A的分子结构中具有的官能团 (写名称)。
(2)若经测定A的结构中无甲基,则A可能的结构简式有 种。其中一种结构为柠檬酸,已知柠檬酸结构中相同的官能团不是连接在同一个碳原子上,且柠檬酸在铜催化条件下不会被氧化,则柠檬酸的结构简式为 。
(3)写出柠檬酸与足量碳酸氢钠溶液反应的化学方程式 。
(4)在一定条件下柠檬酸可以发生化学反应的类型有 (填序号)。
A.取代反应 B.加成反应 C.消去反应 D.中和反应 E.加聚反应
(5)柠檬酸和部分有机物的熔沸点见下表
| 乙酸 | 乙醇 | 乙酸乙酯 | 柠檬酸晶体 | 柠檬酸乙酯(液体) | |
| 沸点(℃) | 118 | 78.5 | 77.1 | 294 | |
| 熔点(℃) | 153 | ―55 |
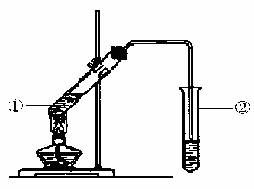
由数据分析柠檬酸与乙醇发生酯化反应,用如下图的装置,在试管②中,能否收集到柠檬酸乙酯(填“能”或“不能”),原因是 。
(6)写出柠檬酸与足量乙醇完全酯化反应的化学方程式 。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com